
| A. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA | |
| B. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| C. | 1mol Na2O2 固体中含离子总数为4NA | |
| D. | 标准状况下,2.24L辛烷所含分子数为0.1NA |
分析 A、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
B、NO2 和 N2O4的最简式均为NO2;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、标况下辛烷为液态.
解答 解:A、7.1g氯气的物质的量为0.1mol,而氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1NA个电子,故A错误;
B、NO2 和 N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个原子,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3mol离子即3NA个,故C错误;
D、标况下辛烷为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol/LH2SO4 | 若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO |
| C | 淀粉碘化钾溶液久置显蓝色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 向含有少量的FeBr3的FeCl3溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl3溶液中的FeBr3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2O7、P2O5、SO3、CO2、NO2均属于酸性氧化物 | |
| B. | K2O、K2O2、KO2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据能否发生丁达尔效应,可以区分胶体和溶液 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 试剂及方法 |
| 证明炭粉中含有CuO | |
| 鉴别MgCl2和AlCl3溶液 | |
| 分离Na2SO4和CaCO3固体混合物 | |
| 除去NaHCO3溶液中混有的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
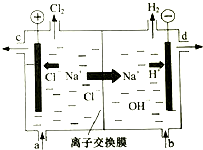 工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.
工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
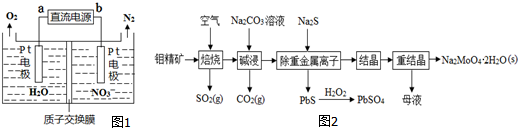
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com