
 .
.分析 A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素;C元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为氧元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,应是氢氧化铝与强酸、强碱之间的反应,且B与C的位置相邻,则B为氮元素、E为Al,甲为HNO3,乙为NaOH,丙为Al(OH)3,据此答题.
解答 解:A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素;C元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为氧元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,应是氢氧化铝与强酸、强碱之间的反应,且B与C的位置相邻,则B为氮元素、E为Al,甲为HNO3,乙为NaOH,丙为Al(OH)3.
(1)乙+丙在溶液中反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)化合物NH3与NO在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,应生成氮气与水,其反应的化学方程式为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{△}$5N2+6 H2O,故答案为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{△}$5N2+6 H2O;
(3)用电子式表示化合物Na2O的形成过程: ,
,
故答案为: ;
;
(4)某原电池中,电解质为KOH溶液,分别向负极通入CO,向正极通入O2,正极反应:O2+4e-+2H2O=4OH-,负极反应:2CO-4e-+8OH-=2CO32-+4H2O,
故答案为:O2+4e-+2H2O=4OH-;2CO-4e-+8OH-=2CO32-+4H2O.
点评 本题考查位置结构性质关系应用,侧重对化学用语的考查,推断元素好似解题关键,注意对基础知识的理解掌握.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数相同的元素一定属于同一族 | |
| B. | 同周期元素的电子层数相同 | |
| C. | 非金属元素的最外层电子数都≧4 | |
| D. | 元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12lg CCl2F2所含的氯原子数为2NA | |
| B. | 常温常压下l mol NO2气体与水反应生成NA个NO3一离子 | |
| C. | 氯化氢气体的摩尔质量等于NA个氯原子和NA个氢原子的质量之和 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


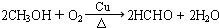 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com