
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应. 2R﹣C≡C﹣H ![]() R﹣C≡C﹣C≡C﹣R+H2
R﹣C≡C﹣C≡C﹣R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线: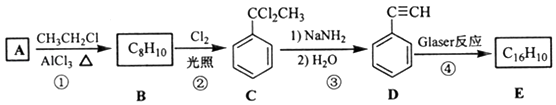
回答下列问题:
(1)B的结构简式为 , D 的化学名称为 .
(2)①和③的反应类型分别为、 .
(3)E的结构简式为 . 用1mol E合成1,4﹣二苯基丁烷,理论上需要消耗氢气mol.
(4)化合物( ![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
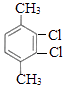
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中2种的结构简式 , .
【答案】
(1)![]() ;苯乙炔
;苯乙炔
(2)取代反应;消去反应
(3)![]() ;4
;4
(4)n ![]()
![]()
![]() +(n﹣1)H2
+(n﹣1)H2
(5)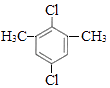 ;
; 
【解析】解:(1)根据以上分析,B的结构简式为 ![]() ,D的化学名称为苯乙炔,
,D的化学名称为苯乙炔,
所以答案是: ![]() ;苯乙炔;(2)根据以上分析,①为A与氯乙烷发生取代反应生成B,③为C脱去2分子HCl发生消去反应生成碳碳三键得到D,
;苯乙炔;(2)根据以上分析,①为A与氯乙烷发生取代反应生成B,③为C脱去2分子HCl发生消去反应生成碳碳三键得到D,
所以答案是:取代反应、消去反应;(3)E的结构简式为 ![]() ,用1mol E合成1,4﹣二苯基丁烷,碳碳三键与氢气发生加成反应,理论上需要消耗氢气4mol,
,用1mol E合成1,4﹣二苯基丁烷,碳碳三键与氢气发生加成反应,理论上需要消耗氢气4mol,
所以答案是: ![]() ;4;(4)化合物(
;4;(4)化合物( ![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:n ![]()
![]()
![]() +(n﹣1)H2,
+(n﹣1)H2,
所以答案是:n ![]()
![]()
![]() +(n﹣1)H2;(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,可能的结构简式为:
+(n﹣1)H2;(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,可能的结构简式为: 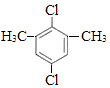
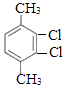
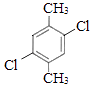
![]()
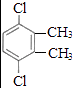 中任意2种;
中任意2种;
所以答案是: 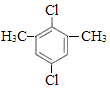 、
、  .
.


科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03 mol/(Lmin)
B.v(N2)=0.02mol/(Lmin)
C.v(NH3)=0.17mol/(Lmin)
D.v(NH3)=0.01mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并按照图示安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。

请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为________________________________。
(2)从A管中可观察到____________的实验现象。从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______________________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?__________,原受热部分的铜丝有什么现象?____________,产生这种现象是因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化 测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是____________,所需要的玻璃仪器有烧杯、1000 mL容量瓶、_____;
(2)步骤二中加入活性炭的作用是____;抽滤使用的主要仪器是____;
(3)在步骤二和步骤三中均加入草酸溶液的目的是___________;
(4)步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 ________填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y2Z 达到平衡时,Y的转化率为![]() 则它们的物质的量满足的关系式成立的是 ( )
则它们的物质的量满足的关系式成立的是 ( )
A. n(X)+n(Y)=n(Z) B. n(X)+2n(Y)=n(Z) C. n(X)+n(Y)=2n(Z) D. 2n(X)+n(Y)=n(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:C6H6 + HNO3 ![]() C6H5—NO2 + H2O ΔH < 0。已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
C6H5—NO2 + H2O ΔH < 0。已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质 | 苯 | 硝基苯 | 间二硝基苯 | 浓硝酸 | 浓硫酸 |
沸点/℃ | 80 | 211 | 301 | 83 | 338 |
溶解性 | 微溶于水 | 难溶于水 | 微溶于水 | 易溶于水 | 易溶于水 |
下列说法不正确的是
A. 制备硝基苯的反应类型为取代反应
B. 采用蒸馏的方法可将硝基苯从反应所得产物中首先分离出来
C. 该反应温度控制在50-60℃的原因是减少反应物的挥发和副产物的生成
D. 采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行反应mX(g)+nY(g) ![]() qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的逆反应速率是Y的正反应速率的n/m倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,X的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 
A.P3<P4 , y轴表示B的体积分数
B.P3<P4 , y轴表示混合气体的密度
C.P3>P4 , y轴表示B的百分含量
D.P3>P4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键
C. NH5的电子式为![]()
D. 它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com