
下表是A、B、C、D、E五种有机物的有关信息:

根据表中信息回答下列问题:
(1)A与溴水反应的生成物的名称叫做 ;写出在一定条件下,A生成高分子化合物的化学方程式: 。
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式 。当n= 时,这类有机物开始出现同分异构体。
(3)B具有的性质是 (填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(4)写出由C氧化生成D的化学方程式: 。
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为 ;其化学方程式为: 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:填空题
Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。
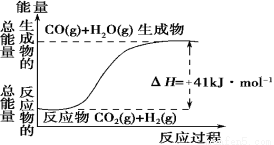
A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1 、△H2、△H3的式子表示)。
、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g) H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJ•mol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 |
| 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k 逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:选择题
用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A.放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
B.充电时,当阳极质量增加23.9g时,溶液中有0.2 mol电子通过
C.放电时,正极区pH增大
D.充电时,Pb电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三一模理综化学试卷(解析版) 题型:实验题
(化学与技术)某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
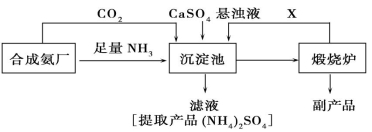
请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生。沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因是 。
(2)在上述流程的沉淀池中通入足量氨气的目的是 ,可以循环使用的X是 。
(3)该生产过程中的副产品是 。从绿色化学和资源综合利用的角度说明上述流程的主要优点是 。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三一模理综化学试卷(解析版) 题型:选择题
下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有( )
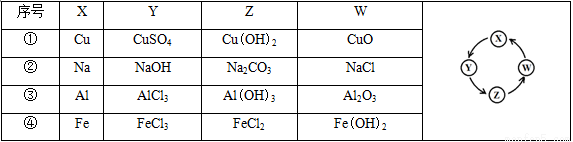
A.②③ B.①③④ C.①④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用下图乙所示方法。已知:磷酸 铁锂电池溶解在中含有、、、、等离子及少量不溶物,滤液c中含有大量离子,可溶于冷水,不溶于热水。
铁锂电池溶解在中含有、、、、等离子及少量不溶物,滤液c中含有大量离子,可溶于冷水,不溶于热水。


下列说法不正确的是( )
A.向滤液a中加入适量溶液,可以得到白色沉淀
B.滤液b中加入氨水的目的是使沉淀,滤渣c为红褐色
C.要将Li从溶液中析出,可在滤液c中加入足量溶液,加热浓缩,冷却结晶
D.图中的氨水可以用适量NaOH溶液代替
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。 下列有关说法不正确的是( )
下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.4mol/L
C.产生的NO在标准状况下的体枳为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为lmol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则95℃时,水的电离平衡曲线应为B,请说明理由______________________.
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是______________.
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______________α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上入学考试化学试卷(解析版) 题型:选择题
将100g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液。下列说法中正确的是( )
A.若c1 = 2c2,则w1<2w2,V<100mL
B.若c1 = 2c2,则w1>2w2,V>100mL
C.若w1 = 2w2,则c1>2c2,V=100mL
D.若w1 = 2 w2,则c1>2c2,V<100mL
w2,则c1>2c2,V<100mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com