


| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
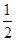 算,顶点上按
算,顶点上按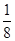 算,棱上按
算,棱上按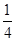 算,体心按1个算,可得O2-个数为:
算,体心按1个算,可得O2-个数为: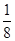 ×8+
×8+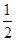 ×2+
×2+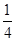 ×4+1=4(个)。
×4+1=4(个)。

科目:高中化学 来源:不详 题型:单选题

| A.①和②变化过程中都会放出热量 |
| B.氯原子吸引电子的能力强于钠原子和氢原子 |
| C.①和②中的氯原子均得到1个电子达到8电子稳定结构 |
| D.NaCl中含有离子键,HCl中含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.6种 | B.7种 | C.10种 | D.12种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 2CO+O2
2CO+O2 2H2+O2
2H2+O2 4NH3+3O2
4NH3+3O2 2CH3OH+3O2
2CH3OH+3O2 ________+3O2。
________+3O2。| A.过程Ⅰ是将太阳能转化成化学能 |
| B.反应⑤的另一种产物为CH4 |
| C.ΔH1=-ΔH2 |
| D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素Y和Q可形成一种化合物Y2O3 |
| B.T和Z各有一种单质的空间构型为正四面体形 |
| C.X和Q结合生成的化合物为离子化合物 |
| D.ZO2是极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com