
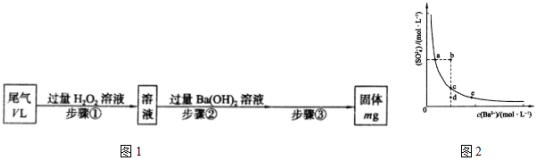
分析 (1)过程中发生的反应为:SO2+H2O2=H2SO4,H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(2)步骤③的操作是从溶液中分离出沉淀硫酸钡,操作步骤是过滤、洗涤、干燥、称重;
(3)溶度积常数随温度变化,不随浓度改变;沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;
(4)mg是硫酸钡的质量,计算硫酸钡的物质的量,根据硫元素守恒计算二氧化硫的体积,进而计算二氧化硫的体积分数;
解答 解:(1)步骤①中加入H2O2溶液,过氧化氢具有氧化性,二氧化硫具有还原性被氧化为硫酸,发生反应的离子方程式为H2O2+SO2=2H+++SO42-,
故答案为:H2O2+SO2=2H+++SO42-;
(2)沉淀溶解平衡中硫酸根离子浓度和钡离子浓度乘积为常数,随着加入的钡离子浓度增大,硫酸根离子浓度减小;始终是饱和溶液中的沉淀溶解平衡,应在曲线上变化;bd点不是该温度下的饱和溶液;
故答案为:不变,③;
(4)mg是硫酸钡的质量,硫酸钡的物质的量为$\frac{mg}{233g/mol}$=$\frac{m}{233}$mol,根据硫元素守恒可知二氧化硫的体积为$\frac{m}{233}$mol×22.4L/mol=$\frac{22.4m}{233}$L,故尾气中二氧化硫的体积分数=$\frac{\frac{22.4.m}{233}L}{VL}$=$\frac{22.4m}{233V}$×100%;
故答案:$\frac{22.4m}{233V}$×100%;
点评 本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算、沉淀溶解平衡等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
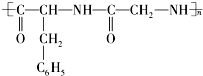 的单体是( )
的单体是( )| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol丙烷分子中,含有的非极性共价键数目为NA | |
| B. | 标准状况下,1.8gH2O分子中所含有的电子数为NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| D. | 2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2混合通入水中后可能使品红褪色 | |
| B. | 二氧化硫的排放会导致光化学烟雾和酸雨的产生 | |
| C. | 单质硫在自然界只以化合态存在 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
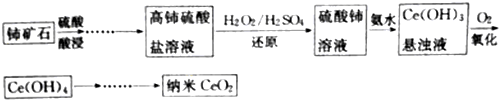
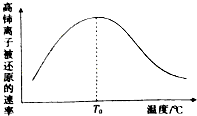
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com