
【题目】Ⅰ.某温度下,在2L的密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ![]() cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
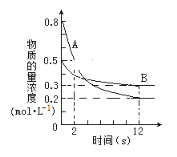
(1)化学计量数b:c=_______
(2)前12s内,A的平均反应速率为________________
(3)12s内,A和B反应放出的热量为__________
Ⅱ.已知:Cu+2FeCl3=2FeCl2+CuCl2利用这一反应,试设计一个原电池,指出电极材料名称,并写出电极反应式
正极:__________ 电极反应:__________________
负极:__________ 电极反应:__________________
【答案】b:c =1:2 0.05molL-1s-1 0.4QkJ 碳棒 2Fe3++2e-=2Fe2+ 铜 Cu-2e-=Cu2+
【解析】
根据图象中各物质的浓度变化量的比值确定方程式的系数。根据热化学方程式中化学计量数为物质的量分析反应热。根据原电池中负极失去电子发生氧化反应,正极得到电子发生还原反应分析原电池的正极和电极反应。
Ⅰ. (1)从图分析,起始A、B的浓度为0.8mol/L,0.5 mol/L,平衡时浓度分别为0.2 mol/L,0.3 mol/L,C的平衡时的浓度为0.8mol÷2L=0.4 mol/L,所以改变量分别为08mol/L-0.2mol/L=0.6 mol/L,0.5mol/L-0.3mol/L=0.2 mol/L,0.4 mol/L,比例为0.6:0.2:0.4=3:1:2。所以 b:c =1:2;
(2) 前12s内,A的平均反应速率为0.6mol/L÷12s=0.05molL-1s-1;
(3)根据热化学方程式分析,当有3molA反应时放出的热量为QkJ,所以当有0.6mol/L×2L=1.2 mol的A反应时放出的热量为 0.4QkJ;
Ⅱ.根据反应分析,铁离子得到电子,在正极反应,正极材料为碳,电极反应为2Fe3++2e-=2Fe2+,铜失去电子生成铜离子,在负极反应, 电极反应为Cu-2e-=Cu2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】第四期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。
写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.
(2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为___________。
(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;

(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。

(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )

A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”中NaClO的物质的量浓度约为__mol/L。(保留1位小数)
(2)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”,下列说法正确的是___(填序号)。
A.如图所示的仪器中有三种是不需要的
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84g/cm3)的浓硫酸配制500mL2.3mol/L的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为___mL。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
③配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是人类较早发现和使用的一种重金属,工业上用铅精矿(主要成分含PbS)为原料,分火法和湿法两种方法冶炼。
Ⅰ.火法冶炼粗铅的流程如下:

(1)焙烧炉中主要反应的化学方程式为______________________。
(2)鼓风炉中焦炭的作用是___________,吸收塔中反应的离子方程式为___________。
Ⅱ.湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在含Cl-的溶液中存在平衡:
PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)浸取过程中发生反应的离子方程式为______________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,其合理的解释为___________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。则阴极室中的电极反应式为___________;若该电解装置的外接电源为铅蓄电池,每生成20.7g铅,铅蓄电池中消耗硫酸的物质的量为___________。

(6)目前炼铅工艺以火法为主,但湿法炼铅也有其明显的优点,其优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合肼法制备叠氮化钠的工艺流程如图所示:
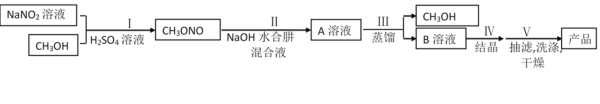
一、合成水合肼
己知:![]() (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。![]() (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
合成![]() 的装置如图1所示。
的装置如图1所示。![]() 碱性溶液与尿素
碱性溶液与尿素![]() 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出![]() 的结构式____________,
的结构式____________,![]() 的电子式____________
的电子式____________
(2)①写出制取![]() 的离子方程式___________________________
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________理由是_______________图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出![]() ,应该采用的分离方法最合理的是________。
,应该采用的分离方法最合理的是________。
二、合成叠氮化钠(![]() )晶体
)晶体
已知:相关物质的物理性质如下表
熔点℃ | 沸点℃ | 溶解性 | |
| -97 | 67.1 | 与水互溶 |
水合肼( | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯( | -17 | -12 | 溶于乙醇、乙醚 |
NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
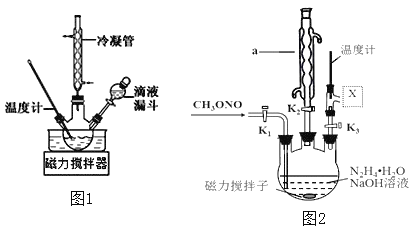
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________。(写出1点即可)
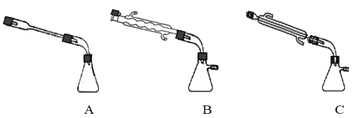
②图中![]() 处连接的最合适装置应为下图中的__________。
处连接的最合适装置应为下图中的__________。
③步骤Ⅱ中制备叠氮化钠的操作是________(填序号)步骤Ⅲ中溶液![]() 进行蒸馏的合理操作顺序是_______。(填序号)
进行蒸馏的合理操作顺序是_______。(填序号)
①打开![]() ,关闭
,关闭![]() ②打开
②打开![]() ③加热 ④关闭
③加热 ④关闭![]()
(4)步骤Ⅳ对溶液![]() 加热蒸发至溶液体积的
加热蒸发至溶液体积的![]() ,
,![]() 结晶析出。步骤Ⅴ可以用________洗涤晶体。
结晶析出。步骤Ⅴ可以用________洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
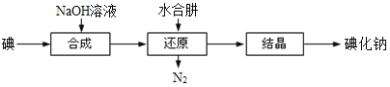
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.  吸收HCl气体,并防止倒吸
吸收HCl气体,并防止倒吸
B. ![]() 准确量取一定体积K2Cr2O7标准溶液
准确量取一定体积K2Cr2O7标准溶液
C.  制备碳酸氢钠
制备碳酸氢钠
D.  蒸干FeCl3溶液制备无水FeC13
蒸干FeCl3溶液制备无水FeC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com