
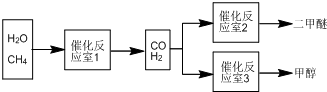
分析 (1)10min内反应的平均速率v(CO)=$\frac{\frac{△n}{V}}{△t}$,v(H2)=3v(CO);该反应平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)CH3OCH3 (g)+3O2(g)=2 CO2(g)+3H2O(g)△H=-1323KJ/mol①;
2H2(g)+O2(g)═2H2O(g)△H=-484KJ/mol②;
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)H=-283KJ/mol③,
将方程式2②+2③-①得2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),焓变进行相应的改变;
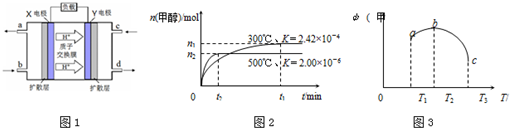
(3)根据氢离子移动方向知,X是负极、Y是正极,该原电池是燃料电池,则X电极上二甲醚失电子发生氧化反应、Y电极上氧气得电子发生还原反应,X电极上二甲醚失电子生成二氧化碳和氢离子;
(4)①升高温度平衡向吸热方向移动,根据甲醇的物质的量多少判断焓变;
②A.温度越高化学反应速率越快;
B.该反应的正反应是放热反应,升高温度平衡逆向移动;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,温度由T1到T2平衡正向移动,由T2到T3平衡逆向移动;
D.该反应为放热反应,升高温度,平衡逆向移动;反应后气体体积小于反应前,减小压强.平衡逆向移动.
解答 解:(1)10min内反应的平均速率v(CO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.1mol}{10L}}{10min}$=0.001mol/(L.min),v(H2)=3v(CO)=0.003mol/(L.min);该反应平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以该反应化学平衡常数K=$\frac{c(CO).{c}^{3}({H}_{2})}{c(C{H}_{4}).c({H}_{2}O)}$,
故答案为:0.003mol/(L.min);K=$\frac{c(CO).{c}^{3}({H}_{2})}{c(C{H}_{4}).c({H}_{2}O)}$;
(2)CH3OCH3 (g)+3O2(g)=2 CO2(g)+3H2O(g)△H=-1323KJ/mol①;
2H2(g)+O2(g)═2H2O(g)△H=-484KJ/mol ②;
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)H=-283KJ/mol③,
将方程式2②+2③-①得2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),△H=2×(-484kJ/mol)+2×(-283kJ/mol)-(-1323kJ/mol)=-211kJ/mol,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
(3)根据氢离子移动方向知,X是负极、Y是正极,该原电池是燃料电池,则X电极上二甲醚失电子发生氧化反应、Y电极上氧气得电子发生还原反应,X电极上二甲醚失电子生成二氧化碳和氢离子,电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,
故答案为:(CH3)2O-12e-+3H2O=2CO2+12H+;
(4)①升高温度平衡向吸热方向移动,根据图知,升高温度甲醇体积分数降低,说明平衡逆向移动,则正反应是放热反应,焓变小于0,故答案为:<;
②A.温度越高化学反应速率越快,温度T1<T2<T3,所以反应速率a<b<c,故A错误;
B.该反应的正反应是放热反应,升高温度平衡逆向移动,温度T1<T2<T3,所以CO转化率a>b>c,故B正确;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,温度由T1到T2平衡正向移动,由T2到T3平衡逆向移动,所以a未达到平衡状态,b可能达到平衡状态,c达到平衡状态,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动;反应后气体体积小于反应前,减小压强.平衡逆向移动,故将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压,故D正确,
故答案为:BD.
点评 本题考查化学平衡计算、原电池原理等知识点,侧重考查学生图象分析判断及计算能力,难点是电极反应式的书写及(4)图象分析,易错点是(4)②中C平衡点判断,题目难度中等.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
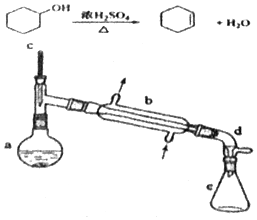 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com