
分析 (1)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)1mol H2SO4溶液与足量 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
依据盖斯定律计算(2)×2+(3)×2-(1)得到C和H2和O2 生成CH3COOH的热化学方程式:
2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol.
点评 本题考查了热化学方程式的书写方法,主要是燃烧热概念的理解分析,盖斯定律计算应用,键能计算费用焓变的方法,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C原子的轨道表示式: | |
| B. | N原子轨道表示式: | |
| C. | Cr基态原子核外电子排布式:[Ar]3d54s1 | |
| D. | Ca原子的电子排布式:[Ar]3d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②⑧①⑦④⑤⑥ | B. | ③②④①⑦⑧⑤⑥ | C. | ①③④⑦⑧⑤⑥② | D. | ②①③④⑦⑧⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
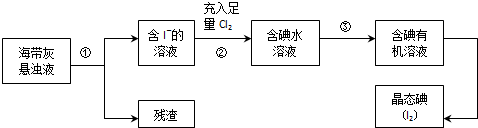
 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 双氢青蒿素属于酯类物质 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素环上的一氢取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,甲烷则不能使其褪色 | |
| B. | 溶于水能导电的化合物不一定是离子化合物 | |
| C. | 需要加热的反应不一定是吸热反应 | |
| D. | 石油的分馏和煤的干馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
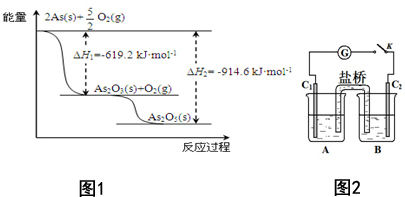 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com