
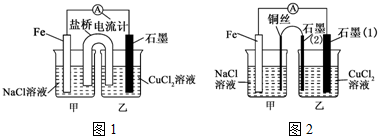
分析 (1)根据自发氧化还原反应知识来书写,并根据两极反应结合两极质量变化进行计算;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,正极生成氢气;
(3)根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池;
(4)阴极反应:Cu2++2e-=Cu,当该极增重1.28g即0.02mol时,转移电子是0.04mol,结合总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑计算pH.
解答 解:(1)设计的原电池装置的自发氧化还原反应是:Fe+Cu2+=Cu+Fe2+,设电子转移量是x,则64×0.5x+56×0.5x=12,解得x=0.2,
故答案为:Fe+Cu2+=Cu+Fe2+;0.2;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:NH4++H2O?NH3•H2O+H+,正极发生2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;酸性;NH4++H2O?NH3•H2O+H+;
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,Cu丝是正极,所以其中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,故答案为:阴;2Cl--2e-=Cl2↑;
(4)阴极反应:Cu2++2e-=Cu,当该极增重1.28g即0.02mol时,转移电子是0.04mol,总反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,可知生成0.04molH+,
则c(H+)=$\frac{0.04mol}{0.4L}$=0.1mol/L,pH=1,
故答案为:1.
点评 本题涉及原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,为高频考点,侧重于学生的分析、计算能力的考查,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题
 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1 CH3COOH溶液 | |
| B. | 10-3 mol•L-1 H2SO4浓缩到原体积的10倍. | |
| C. | pH=1的H2SO4溶液稀释10倍 | |
| D. | c(OH-)=10-2 mol•L-1 的某溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| D. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸生产中常采用高压条件提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电解精炼铜时,溶液中c(Cu2+)会略有减小 | |
| D. | 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入氢氧化钠溶液中:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com