
分析 同温同压下,若甲烷(CH4)和氨气(NH3)的体积相同,两者的物质的量相等,所以质量之比等于摩尔质量之比,则质量比为16:17,根据$ρ=\frac{m}{V}$,体积相同时等于质量之比,密度之比为 16:17,甲烷的分子式为CH4,则含氢原子数相等的甲烷和氨气的物质的量之比为3:4,物质的量之比等于体积之比,由此分析解答.
解答 解:同温同压下,若甲烷(CH4)和氨气(NH3)的体积相同,两者的物质的量相等,所以质量之比等于摩尔质量之比,则质量比为16:17,根据$ρ=\frac{m}{V}$,体积相同时等于质量之比,密度之比为 16:17,甲烷的分子式为CH4,则含氢原子数相等的甲烷和氨气的物质的量之比为3:4,物质的量之比等于体积之比,所以它们的体积比为 3:4,故答案为:16:17;16:17; 3:4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题侧重考查学生的化学计算能力.


科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 硅胶可作袋装食品的干燥剂 | |
| D. | 玻璃容器可长期盛放各种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 描述 | 解释 |
| A | 凡火药,硫为纯阳,硝为纯阴,此乾坤幻出神物也 | “硝”指的是硝酸钾 |
| B | 凡墨烧烟凝质而为之 | “烟”指的是焦炭 |
| C | 凡墨伪方士以炉火惑人者,唯朱砂银愚人易惑 | “朱砂银”指的是Ag2S |
| D | 五金之长,熔化成形之后,住世永无变更 | 这名话描述的对象为Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类在一定条件下都可以水解生成乙醇和二氧化碳 | |
| B. | 乙酸乙酯和油脂都属于酯类物质,碱性条件水解称之为皂化反应 | |
| C. | 硝酸汞溶液加入到鸡蛋清中,可以使蛋清液盐析而沉淀下来 | |
| D. | 淀粉在稀硫酸加热催化下,水解产物葡萄糖的检出,先加入NaOH溶液后加入银氨溶液水浴加热,看是否有银镜出现.若出现银镜,证明有葡糖糖生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
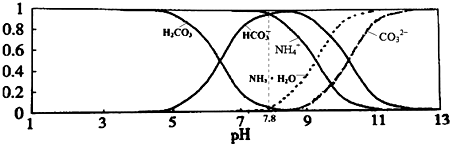
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com