
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
B | 向2mL NaCl和NaI(浓度均为0.1 mol·L-1 )混合溶液中滴入2滴0.1 mol·L-1 AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或Ag+ |
D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:填空题
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+ (En 是乙二胺的简写):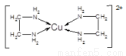
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为________,该元素位于周期表区________,C、N、O 三种元素的第一电离能由大到小的顺序是________;
(2)乙二胺分子中氮原子轨道的杂化类型为________,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是________。
(3)CuCl的晶胞结构如右图 所示,其中Cl-的配位数为________,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为________g/cm3。
所示,其中Cl-的配位数为________,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为________g/cm3。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则下列叙述中正确的是

A.电极Ⅰ发生还原反应
B.电流方向:电极Ⅳ →  → 电极Ⅰ
→ 电极Ⅰ
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O
B.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑
C.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓
D.用惰性电极电解氯化镁溶液:Mg2++2Cl-+2H2O Cl2↑+H2↑+Mg(OH)2↓
Cl2↑+H2↑+Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:实验题
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:
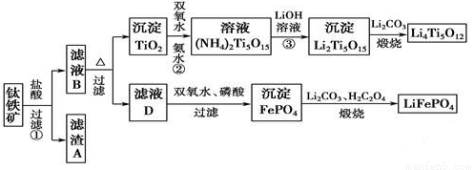
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
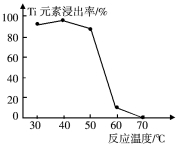
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关,下列说法正确的是:
A.研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放
B.联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气
C.接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫
D.工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:推断题
如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
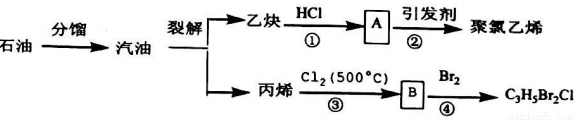
(1)写出反应②的化学方程式__________。
(2)B分子中无甲基,则B的结构简式为__________。系统命名为__________。
(3)反应①和③的类型依次是__________、__________。
(4)写出反应③化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
Ⅰ、次氯酸钠是一种被广泛应用的消毒剂,请回答下列问题:
(1)写出NaClO的电子式___________________。
(2)已知HClO的电离能力介于H2CO3一级与二级电离之间,写出NaClO溶液中通入少量CO2过程中发生的离子反应方程式为________________________
(3)在NaClO溶液中通入少量SO2,其反应离子方程式:________________________
II、某二元化合物X其相对分子质量小于100,常温下为黄绿色或橘黄色气体,性质非常不稳定,若用“惰性气体”等稀释时,爆炸性 则大大降低,X的水溶液质量分数高于30%也有可能引起爆炸。X可由KClO3和草酸(H2C2O4)混合物中加入足量的稀硫酸水浴加热制得,12.25 g KClO3与9 g草酸恰好完全反应生成X、CO2和一种酸式盐。
(1)确定X的化学式_______________
(2)用H2C2O4溶液、稀硫酸和KC1O3制备X最大优点是 ______________
(3)工业废水中Mn2+常用X处理,将Mn2+转化为MnO2,写出X除去Mn2+的离子方程式 _____________
(4)纤维素还原法制X是一种新方法,其原理是:纤维素水解得到的最终产物与稀硫酸、NaClO3反应生成X。完成反应的化学方程式:_____________
(5)实验室用氢氧化钠溶液吸收X尾气,生成等物质的两种钠盐,其中有一种盐为NaClO3完成氢氧化钠溶液吸收X尾气反应的化学方程式:_____________
(6)X和Cl2均能将电镀废水中的CN-氧化为无毒的物质。处理含CN-相同量的电镀废水,所需Cl2的物质的量是X的_______倍
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如下图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是
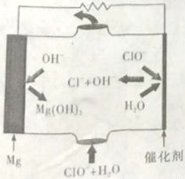
A.该电池中镁为负极,发生还原反应
B.该电池的总反应为:Mg + ClO-+ H2O = Mg(OH)2↓+ Cl-
C.电池工作时,正极周围溶液的pH将不断变小
D.电池工作时,OH-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com