
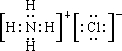 .
.分析 (1)①NH4Cl含有离子键和共价键,其电子式为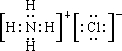 ;
;
②NH4Cl为强酸弱碱盐,水解呈酸性;
③由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg/L×103 L×103 g/mg 0.1mol/L×V,解之得:污水中的氨气被空气带走,有利于NH3•H2O?NH3+H2O的平衡正向移动;
(2)①1mol铵根离子反应生成亚硝酸根时转移6mol电子,1mol氧气反应转移4mol电子,据最小公倍法可知,铵根离子化学计量数为2,氧气化学计量数为3,2NH4++3O2═2NO2-+4H++H2O;
②CO32-水解呈碱性,pH增大,且可生成FeCO3沉淀而阻止反应进行.
解答 解:(1)①NH4Cl含有离子键和共价键,其电子式为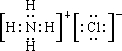 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键;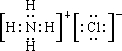 ;
;
②氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O?H++NH3•H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:NH4++H2O?H++NH3•H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
③由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg/L×103 L×103 g/mg 0.1mol/L×V,
$\frac{53.5}{180}=\frac{1}{0.1V}$,解之得:V=33.64L,污水中的氨气被空气带走,有利于NH3•H2O?NH3+H2O的平衡正向移动,利于除去氮,故答案为:33.64L;污水中的氨气被空气带走,有利于NH3•H2O?NH3+H2O的平衡正向移动,利于除去氮;
(2)①1mol铵根离子反应生成亚硝酸根时转移6mol电子,1mol氧气反应转移4mol电子,据最小公倍法可知,铵根离子化学计量数为2,氧气化学计量数为3,所以反应的离子方程式为:2NH4++3O2═2NO2-+4H++H2O,故答案为:2NH4++3O2═2NO2-+4H++H2O;
②CO32-水解呈碱性,CO32-+H2O?HCO3-+OH-,pH增大,且发生Fe2++CO32-=FeCO3↓,可生成FeCO3沉淀而阻止反应进行,
故答案为:CO32-+H2O?HCO3-+OH-增大了溶液的pH会降低脱氮效果,且Fe2++CO32-=FeCO3↓覆盖在反应物的表面阻止反应进行.
点评 本题考查物质的性质探究,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理、方法和注意事项,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 21.9% | B. | 43.1% | C. | 13.5mol/L | D. | 5.67mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
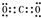 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
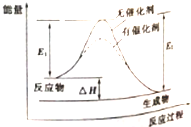
| A. | 该反应能量变化类型与CaCO3分解反应相同 | |
| B. | 加催化剂后,正反应速率加快,逆反应速率减小 | |
| C. | 若该反应为氧化还原反应,则可以将其设计成原电池 | |
| D. | 反应热△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com