
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题: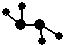 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: ,则E为N2H4;
,则E为N2H4; ,则E为N2H4;
,则E为N2H4;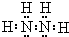 ,故答案为:
,故答案为: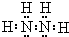 ;
;

科目:高中化学 来源: 题型:
| A、①②③⑤ | B、④⑥⑦⑧ |
| C、①④⑥⑦ | D、②③⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③①②④ |
| C、④①②③ | D、②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、38 | B、55 |
| C、100 | D、135 |
查看答案和解析>>
科目:高中化学 来源: 题型:
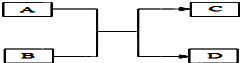 A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
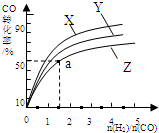 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.| 3 |
| 2 |
| n(CH3OH) |
| n(CO2) |
| 温 度 | 300℃ | 400℃ | 500℃ |
| n(甲醇)/mol | 0.21 | 0.17 | 0.11 |
| n(H2) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
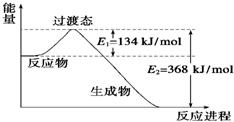 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com