
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO 3溶液中:SO2+H2O+2 CO
3溶液中:SO2+H2O+2 CO =SO
=SO +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
T ℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法不正确的是( )
TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法不正确的是( )

A.0~t min内,v(I2)=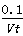 mol·L-1·min-1
mol·L-1·min-1
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为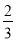
C.图中制备TaS2晶体过程中循环使用的物质是I2(g)
D.图中T1端得到纯净TaS2晶体,则温度T1<T2
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1∶2;
B.烧瓶内气体的颜色不再加深;
C.烧瓶内气体的平均相对分子质量不再变化;
D.烧瓶内气体的压强不再变化。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:推断题
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题:

(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为___________,D的电子式为___________;
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________溶液(填溶质的化学式),写出B溶液中显电中性的原因___________,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________。
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H________ △H1.(填“>”、“<”或“=”);
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII ________EIII(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:填空题
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
A.若管道漏气遇NH3就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
为证明溴乙烷中含有溴元素,向溴乙烷中依次加入下列药品并加热,操作步骤中正确的是①加入硝酸银溶液 ②加入氢氧化钠溶液或加入氢氧化钠醇溶液③加热④加入蒸馏水⑤加入稀硝酸至溶液呈酸性
A.④③①⑤ B.②③⑤① C.④⑤③① D.①②③⑤
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
下列有关性质的比较,不能用元素周期律解释的是( )
A.热稳定性:Na2CO3>NaHCO3 B.非金属性:Cl>Br\
C.碱性:NaOH>Mg(OH)2 D.酸性:H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
下列反应中,硝酸既表现酸性,又表现氧化性的是( )
A.Fe2O3跟稀硝酸反应 B.Al(OH)3跟稀硝酸反应
C.CuO跟稀硝酸反应 D.Fe(OH)2跟稀硝酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com