
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
| 1×10-14 |
| 10-(14-a) |
| 1×10-14 |
| 10-(14-a) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应达到平衡时c(Cu2+)=c(Mn2+) | ||
| B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小 | ||
| C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 | ||
D、该反应的平衡常数K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、后一反应的平衡常数为1 |
| B、后一反应的平衡常数为0.5 |
| C、后一反应达到平衡时,H2的平衡浓度为0.25mol?L-1 |
| D、后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
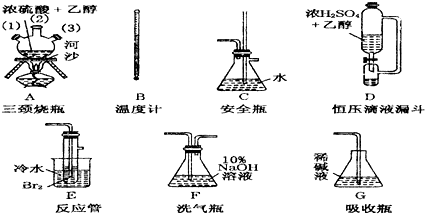
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com