
| A. | 两个非金属元素的原子 | B. | 同周期元素的原子 | ||
| C. | 同主族元素的原子 | D. | 活泼金属与活泼非金属的原子 |
分析 A.两个非金属元素的原子之间只能形成共价键;
B.同周期元素的原子之间可能形成离子键,如Na与Cl等;
C.同主族元素的原子之间可能形成离子键,如Na与H;
D.活泼金属与活泼非金属的原子之间可能形成离子键,也可能形成共价键,如Al与Cl.
解答 解:A.非金属原子不易失去电子,两个非金属元素的原子之间只能形成共价键,故A正确;
B.同周期元素的原子之间可能形成共价键,如C与O,也可能形成离子键,如Na与Cl等,故B错误;
C.同主族元素的原子之间可能形成共价键,如S与O,也可能形成离子键,如Na与H,故C错误;
D.活泼金属与活泼非金属的原子之间可能形成离子键,也可能形成共价键,如Al与Cl,故D错误,
故选:A.
点评 本题考查离子键与共价键形成条件,比较基础,一般是非金属元素原子之间形成共价键,活泼非金属与活泼金属之间形成离子键,注意特殊性,如铵盐、氯化铝.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 一项 | B. | 二项 | C. | 三项 | D. | 四项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
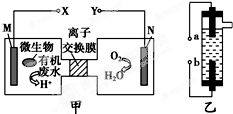
| A. | 装置甲可以在高温环境中工作 | |
| B. | 装置甲中N极发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 装置乙中b极的电极反应式为2H++2e-═H2↑ | |
| D. | 装置乙的a极要与装置甲的Y极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子得电子能力:W<X<Y<Z | B. | 原子最外层电子数::W<X<Y<Z | ||
| C. | 原子半径:W>X>Y>Z | D. | 元素的最高化合价:W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<y | B. | x=y | C. | x>y | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
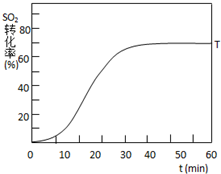 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
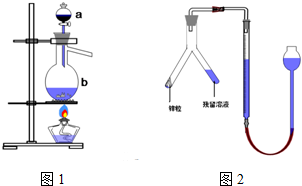
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com