
| A、H+、Ba2+、Fe3+、NO3-,通入SO2气体 |
| B、Ca2+、Cl-、K+、H+,通入CO2气体 |
| C、AlO2-、Na+、Br-、SO42-,通入CO2气体 |
| D、HCO3-、Na+、I-、HS-,加入AlCl3溶液 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
| A、浓氨水滴进碱石灰里可制得氨气 |
| B、锌片与稀硝酸反应可制得氢气 |
| C、用乙醇萃取碘水中的碘单质 |
| D、SO2通入溴水,验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
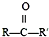 (R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯:
(R、R′代表烷基或H原子)发生缩合反应生成新的有机物和水.苯酚还能发生如下反应生成有机酸酯: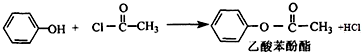
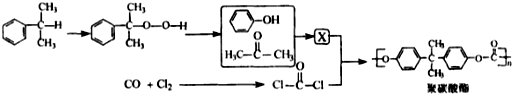
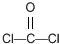 反应合成聚碳酸酯的化学方程式:
反应合成聚碳酸酯的化学方程式: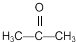 的同分异构体与新制银氨溶液发生反应的化学方程式:
的同分异构体与新制银氨溶液发生反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 |
| B、胶体与溶液的本质区别是能否出现丁达尔现象 |
| C、Al2O3是难熔的物质,可制造耐火坩埚 |
| D、小苏打能与酸反应,医疗上可以治疗胃溃疡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小 |
| C、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
| D、单位时间内消耗CH4和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
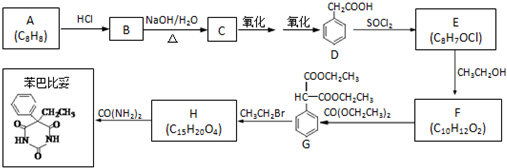
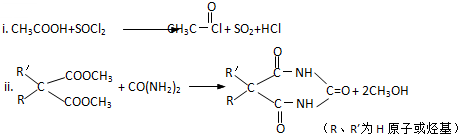
查看答案和解析>>
科目:高中化学 来源: 题型:
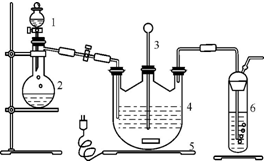 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com