
| A. | HF电离:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 水解消耗0.1mol F-时,吸收的热量为6.77kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1mol HF、0.1mol NaOH 的两种溶液混合后放出的热量为6.77kJ |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.依据反应的热化学方程式,HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol,得到F-(aq)+H2O(1)?HF(aq)+OH-(aq))△H=+67.7kJ/mol;
C.中和热是强酸、强碱的稀溶液全部反应生成1mol水放出的热量;
D.HF是弱酸,电离过程依据A分析可知是放热,则含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量大于6.77 kJ.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A错误;
B.依据反应的热化学方程式,HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol,得到F-(aq)+H2O(1)?HF(aq)+OH-(aq))△H=+67.7kJ/mol,水解消耗0.1 mol F时,吸收的热量为6.77 kJ,故B正确;
C.中和热是强酸强碱的稀溶液全部反应生成1mol水放出的热量,弱酸弱碱或浓溶液反应,中和热不是57.3 kJ/mol,故C错误;
D.HF是弱酸,电离过程依据A分析可知是放热,则含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量大于6.77 kJ,故D错误;
故选B.
点评 本题考查了热化学方程式和盖斯定律的计算应用,注意中和热概念的理解应用,掌握基础是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
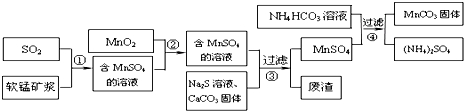
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
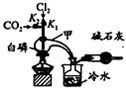 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 L 3 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com