
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||




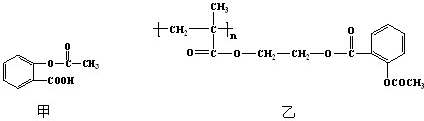




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;镁和钠的化学性质也有一定的相似性。
两个研究性学习小组分别根据不同的微型课题进行研究,其方案如下:

Ⅰ.第一个研究性学习小组用如图所示的装置进行镁与二氧化硫反应的实验。
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:______________________。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体
G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁有淡黄色固体粉末产生,取反应后B中固体溶于稀盐酸中产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式:______________________。
(3)你认为该装置是否有不足之处?______________。如果有,请写出改进方法:______________________________。
Ⅱ.第二个研究性学习小组进行了“实验室制硅”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用木炭粉还原二氧化硅可制得硅 ②镁在点燃条件下即可与二氧化硅反应 ③金属硅化物与稀硫酸反应生成硫酸盐与硅烷 ④硅和二氧化硅均不与稀硫酸反应 ⑤硅烷在空气中能自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制硅”的化学方程式是_________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省八市高三3月联考理科综合试卷(化学部分) 题型:填空题
【化学——选修2:化学与技术】(15分)
自来水生产的流程示意图见下:

(1)混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。
Cl2+H2O  HCl+HClO
K=4.5×10-4
HCl+HClO
K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
。
下列物质中, 可以作为氯气的代用品(填写序号)。
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R'OH型)。
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32- =2I-+S4O62-
则水中的溶解氧量为 mg·L-1。
查看答案和解析>>
科目:高中化学 来源:2010年河南省全真模拟(二)(理科综合)化学部分 题型:填空题
(15分)
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,等浓度的亚硫酸溶液导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol/L的H2SO3溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有Na2SO3和N2H4(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是 。
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是 (填最简整数比)。
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是 。
(4)已知Na2SO3在高温下发生分解,得到两种产物。某同学称取25.2g纯净的Na2SO3·7H2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①Na2SO3高温分解的化学方程式是 。
②测得溶液的pH大于0.025mol/LNa2SO3溶液的pH,试解释原因(结合离子方程式说明) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com