
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 1 mol甲基(-CH3)所含的电子数为10NA
B. 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA
C. 14g由乙烯和环丙烷(![]() )组成的混合气体中,含有的原子总数为3NA
)组成的混合气体中,含有的原子总数为3NA
D. 标准状况下,22.4L四氯化碳中含有共用电子对的数目为4NA
科目:高中化学 来源: 题型:
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
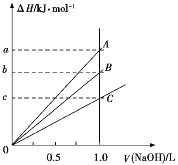
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。


下列说法中,不正确的是
A. 碳纳米管具有导电性,可用作电极材料
B. 放电时,电池的正极反应为:MnO2+e+H+==MnOOH
C. 充电时,Zn2+移向Zn膜
D. 合成有机高聚物的单体是:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应物和生成物均为气态的平衡体系,平衡常数表达式为K=![]() ,有关该平衡体系的说法错误的是
,有关该平衡体系的说法错误的是
A. 升高温度,该反应平衡常数K的变化无法判断
B. 增大压强,W的质量分数减小
C. 该反应的化学方程式为3Z(g)+2W(g)![]() X(g)+2Y(g)
X(g)+2Y(g)
D. 增大X气体的浓度平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
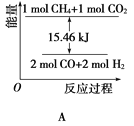



②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
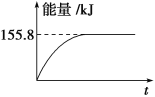
(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A. H2S B. CO2 C.COS D.N2
②在620 K重复实验,平衡后水的物质的量分数为0.03,该反应的ΔH________0(填“>”“<”或“=”)。
③H2S的平衡转化率α1=_____%,反应平衡常数K=______。(第③小题要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com