
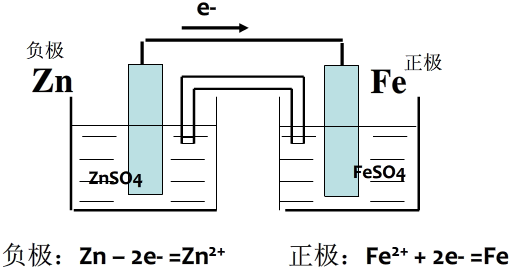
 ,
, ;
;

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大pH |
| B、加入2.0 mol?L-1NH4Cl固体 |
| C、加入MgSO4,固体 |
| D、加入适量95%乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+2 | B、+1 | C、0 | D、-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、+2 | C、+3 | D、+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为:4OH-═O2+2H2O+4e- |
| B、放电时CO32- 向负极移动 |
| C、电池供应1mol水蒸气,转移的电子数为4mol |
| D、放电时CO32- 向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 mol |
| B、2.8 mol |
| C、3.2 mol |
| D、3.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com