
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(H CO3 -)>c(CO3 2-)>c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |


科目:高中化学 来源: 题型:
| A、非金属元素都是主族元素,单质在反应中都只能作氧化剂 |
| B、C、N、S三者的单质直接与氧气反应都能至少生成两种氧化物 |
| C、除惰性元素外,周期表中共有16 种非金属元素 |
| D、氧化物常温下都可以与水反应生成酸,所形成的含氧酸盐(MaROb)中的R 元素必定呈现正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
C、使用聚乙烯塑料制品比使用聚乳酸 (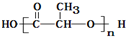 )塑料制品更环保 )塑料制品更环保 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对环境保护、节能减排具有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2+3H2?2NH3△H<0;工业上采用20MPa至50MPa的高压条件 | ||||||||
B、
| ||||||||
C、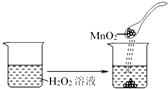 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、AlCl3溶液中加入足量的NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com