
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,据此答题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,则
(1)由以上分析可知,X为S,Y为C,故答案为:S;C;
(2)SO2中,S的价层电子对数为2+$\frac{6-2×2}{2}$=3,含有1对孤对电子,故为V形结构;CO2为直线形;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度更大,
故答案为:V形;直线形;SO2;CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶规则”,SO2在H2O中的溶解度较大;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,最高化合价为+6价,
故答案为:Cr;四;1s22s22p63s23p63d54s1;+6;
(4)HF的水溶液中,F的电负性较大,可与另一分子的HF或水中的H形成氢键,可表示为H-F…H,氧原子和氟化氢分子中的氢原子之间能形成氢键,可表示为 F-H…O,氟原子和水分子中的氢原子能形成氢键,可表示为O-H…F,氧原子和另一个水分子中的氢原子能形成氢键,可表示为O-H…O,
故答案为:F-H…F、F-H…O;O-H…F、O-H…O;
(5)CO2在固态时为分子晶体,结构式为O=C=O,1mol CO2中含2molσ键、2molπ键,
故答案为:分子;2;2.
点评 本题是对物质结构的考查,题目难度中等,关键是把握原子核外电子排布、推断元素的种类,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 做衣服的棉和麻均与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 ③35Cl和37Cl
③35Cl和37Cl 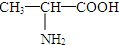 和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3
和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3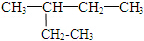 和
和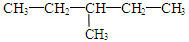
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
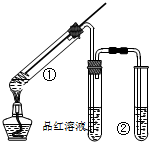 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com