
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb还含有少量的Ag、CaO) 可制备硫酸铅。制备流程图如下:

已知: Ksp(PbSO4)=1.6×10-8Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式__________________,为防止Ag被溶解进入溶液,步骤I操作时应注意____________。
(2)粗PbSO4产品含有的杂质是________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是__________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是_____________________。
(4)若将步骤II中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为_____mol/L。
(5)(CH3COO)2Pb是皮毛行业的染色助剂,可用PbSO4 与CH3COONH4反应制备,写出反应的离子方程式_________________________。
【答案】 3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O 控制硝酸的用量并使铅浮渣(或Pb)稍有剩余(其他合理答案均给分:硝酸不足、浮渣过量、Pb过量、Pb稍有剩余) CaSO4 C 浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率 1.6×10﹣3 PbSO4+2CH3COO﹣=(CH3COO)2Pb + SO42-
【解析】(1)铅与硝酸反应生成一氧化氮和硝酸铅,反应的方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,当铅过量时银不能溶解,所以为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余,故答案为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;控制硝酸的用量并使Pb稍有剩余;
(2)根据流程可知,粗PbSO4产品含有的杂质是CaSO4,可以用Pb(NO3)2溶液洗涤除去,故答案为:CaSO4;C;
(3)硝酸铅与硫酸反应生成硫酸铅和硝酸,硝酸可用于循环利用,若母液中残留的SO42-过多,在步骤I中就会有硫酸铅沉淀出现,会随浸出渣排出,故答案为:浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)Pb2+完全转化成PbSO4沉淀离子浓度小于10-5mol/L,Ksp(PbSO4)=1.6×10-8,则c(SO42-)=![]() =
=![]() =1.6×10-3mol/L,故答案为:1.6×10-3mol/L;
=1.6×10-3mol/L,故答案为:1.6×10-3mol/L;
(5)(CH3COO)2Pb是皮毛行业的染色助剂,可用PbSO4与CH3COONH4反应制备,硫酸铅难溶于水,反应的离子方程式为PbSO4+2CH3COO﹣=(CH3COO)2Pb + SO42-,故答案为:PbSO4+2CH3COO﹣=(CH3COO)2Pb + SO42-。


科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(1)实验目的:制取乙酸乙酯。
(2)实验原理:甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,反应的方程式为______________;其中浓硫酸的作用是______________。
(3)装置设计:甲、乙、丙三位同学分别设计下列三套实验装置。
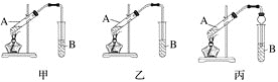
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______________(选填“甲”或“乙”);丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是___________________________。
(4)实验步骤:
①按我选择的装置仪器,在试管中先加入2mL浓硫酸,缓缓加入3mL乙醇充分摇匀,冷却后再加入2mL冰醋酸;
②将试管固定在铁架台上;
③在试管B中加入适量的饱和碳酸钠溶液;
④用酒精灯对试管A加热;
⑤当观察到试管B中有明显现象时停止实验。
你认为实验操作中存在的错误有____________________________________________。
(5)问题讨论:
①试管B中饱和碳酸钠溶液的作用是_________________________________________。
②从试管B中分离出乙酸乙酯的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。

①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是

A. 由图可知,c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C. 恰好中和时,溶液中离子浓度的大小关系: c(Na+)>c(A-)>c(OH-)>c(H+)
D. 由pH=7溶液计算得: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)是提取铝的原料,提取铝的工艺流程如图:

请回答下列问题:
(1)过滤操作需用到的玻璃仪器除烧杯、玻璃棒外,还需要__。
(2)流程图中固体B的成分为__,流程图中试剂X为__。
(3)为验证滤液A含Fe3+,可取少量滤液A滴加__溶液,溶液显红色。
(4)通入过量的CO2时发生的化学方程式为__。
(5)现有102 t含氧化铝50%的铝土矿,理论上可炼出__t金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是一种利用微生物将废水中的尿素CO(NH2)2]转化为环境友好物质的原电也装置示意图,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是
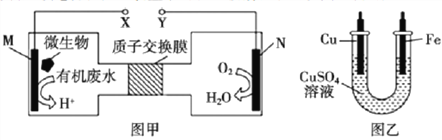
A. 图乙中Fe电极应与图甲中Y相连接
B. 图甲中H+透过质子交护膜由右向左移动
C. 图甲中M电极反应式:CO(NH2)2+5H2O-14e=CO2+2NO2+14H+
D. 当图甲中M电极消耗0.5mol尿素时,图乙中铁电极增重96g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是生产印刷颜料酞菁蓝的重要原料,工业上可用一种低品位铜矿(主要成分CuS、Cu2S、CuO、Fe2O3、FeO及其他非酸溶性杂质)和软锰矿(主要成分为MnO2和其他非酸溶性杂质)来进行生产,过程如下:

回答下列问题:
(1)步骤Ⅰ中反应较多,下列反应是其中之一:Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+4H2O+S,该反应的氧化产物为____________________(填化学式)。
(2)为确定滤液1中是否含有Fe2+,首先用有机萃取剂除去溶液中MnSO4,再取下层水溶液进行检测,所用试剂为_____________________。
(3)步骤Ⅱ加入氨水控制溶液的pH为5左右,目的是______________________。
(4)为模拟步骤Ⅲ的生产过程,某同学设计如下实验,下列有关叙述正确的是_____________。

A.a通入CO2,然后b通入NH3;c中放碱石灰
B.b通入NH3,然后a通入CO2;c中放碱石灰
C.a通入NH3,然后b通入CO2;c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3;c中放蘸稀硫酸|的脱脂棉
(5)步骤Ⅳ的滤液中主要成分X是步骤Ⅱ和步骤Ⅲ都有的产物,可以回收作为肥料使用,该肥料_______(填“可以”或“不可以”)与草木灰(有效成分K2CO3)共用,简述原因:__________。
(6)已知CuCl为难溶于水的白色沉淀,写出步骤Ⅴ发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( ) 
A.电极B为负极
B.电极A的反应式为2NH3﹣6e﹣+6OH﹣=N2+6H2O
C.溶液中OH﹣通过阴离子交换膜从左向右迁移
D.当有4.48LNO2(标准状况下)被处理时,转移的电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的______极,电极反应式为____,发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com