
| A. | 明矾净水的原理和家用消毒液消毒的原理相同,都能起到消毒杀菌作用 | |
| B. | 聚乙烯、聚氯乙烯都是高分子化合物,但聚氯乙烯薄膜不能用于包装食品 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 铝合金的大量使用,归功于人们能用焦炭等还原剂从氧化铝中获得铝 |
分析 A.明矾水溶液中铝离子水解生成具有吸附性氢氧化铝胶体,具有吸附性;
B.聚氯乙烯受热分解产生有毒物质;
C.碳纤维,主要成分为碳单质;
D.铝的冶炼用电解法,通常采用电解氧化铝制取.
解答 解:A.明矾水溶液中铝离子水解生成具有吸附性氢氧化铝胶体,具有吸附性,能够吸附水中固体杂质颗粒而净水,不具有杀菌消毒作用,家用消毒液含有的次氯酸根离子具有强的氧化性能够杀菌消毒,故A错误;
B.聚乙烯、聚氯乙烯都是高分子化合物,聚氯乙烯受热分解产生有毒物质,不能用于食品包装,故B正确;
C.碳纤维,主要成分为碳单质,属于无机非金属材料,故C错误;
D.一般来说,活泼金属用电解法,铝是活泼金属,所以采用电解法冶炼,故D错误;
故选:B.
点评 本题主要考查运用所学化学知识综合分析和解决实际问题的能力,涉及明矾净水原理、金属的冶炼、材料的分类,明确盐类水解的性质、金属的性质、材料的成分是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5 ml | B. | 10 ml | ||
| C. | 15 ml | D. | 条件不足,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | 全部 | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的相对分子质量之差为168 | |
| B. | B一定不能发生加成反应 | |
| C. | 有机物B与CH3CH2OH互为同系物 | |
| D. | 分子式为C5H10O2且与CH3COOH属于同类物质的有机物只有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 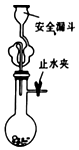 实验室用大理石和盐酸制备二氧化碳 | |
| B. | 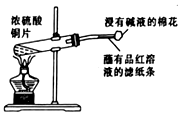 制取SO2、检验SO2的漂白性 | |
| C. | 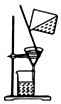 提纯氢氧化铁胶体 | |
| D. | 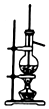 实验室用乙醇和浓硫酸制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com