
SO2、NO2 是大气污染的主要污染物,下列污染现象分别与SO2、 NO2有关的是( )
A.光化学烟雾、温室效应 B.臭氧空洞 、 水体富营养化
C.酸雨、光化学烟雾 D.赤潮、温室效应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:查看答案和解析>>
科目:高中化学 来源: 题型:
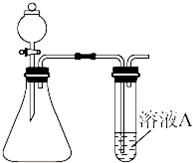 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
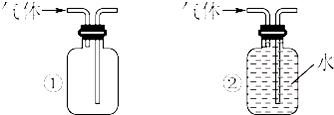
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,下列叙述正确的是
A.相同的甲、乙两容器中分别加入1 g SO2、1 g O2与2 g SO2、2 g O2,发生反应2SO2(g)+O2(g) SO3(g)达到平衡,SO2的转化率前者大
B.反应2HI(g) H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
C.反应2NO2(g ) N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
D.反应2HI(g) H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com