
| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
分析 向各个溶液中加入物质后:发生的反应如下:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,AlO2-+H2O+H+=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,根据反应来回答.
解答 解:A、三溴化铝溶液先是和烧碱反应,出现沉淀,然后是沉淀逐渐溶解,再加入盐酸,出现沉淀,最后是沉淀逐渐溶解,和图象相符,故A不选;
B、偏铝酸钠溶液滴入氢氧化钠,溶液无现象,然后再滴加盐酸,则首先中和溶液中的氢氧化钠,若继续滴加盐酸,则氢氧化铝沉淀,方程式为NaAlO2+H2O+HCl=Al(OH)3↓.当沉淀不再发生变化时,再加入盐酸会溶解氢氧化铝,方程式为Al(OH)3+3HCl=AlCl3+3H2O,所以选项B不符合,故B选;
C、明矾溶液先是和烧碱反应,出现沉淀,然后是沉淀逐渐溶解,再加入盐酸,出现沉淀,最后是沉淀逐渐溶解,和图象相符,故C不选;
D、硝酸铝溶液先是和烧碱反应,出现沉淀,然后是沉淀逐渐溶解,再加入盐酸,出现沉淀,最后是沉淀逐渐溶解,和图象相符,故D不选;
故选B.
点评 本题考查学生含有铝元素的盐和盐酸以及氢氧化钠之间的反应知识,属于综合知识的考查,难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$\stackrel{Cl_{2}}{→}$粗SiCl4$→_{(2)H_{2}/高温}^{(1)分馏提纯}$高纯硅 | |
| C. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗Br2$→_{蒸馏}^{NaBr(s)}$Br2 | |
| D. | 铝土矿$→_{(2)过滤}^{(1)NaOH(aq)}$NaAlO2(aq)$→_{(2)过滤}^{(1)CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{煅烧}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4所含的分子数为NA | |
| B. | 1mol的羟基(-OH)与1 mol的氢氧根(OH -)离子所含电子数均为9 NA | |
| C. | 常温常压下,在30g 的乙烷气体分子中,碳氢键的总个数为6NA | |
| D. | 一定条件下,将2molSO2与足量的O2充分反应,生成SO3的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: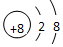 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | MgO$\stackrel{H_{2}SO_{4}}{→}$MgSO4(aq)$\stackrel{电解}{→}$Mg | |
| C. | 饱和NaCl(aq)$\underset{\stackrel{①N{H}_{3}}{→}}{②C{O}_{2}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 油脂水解生成甘油和高级脂肪酸或高级脂肪酸盐 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 重油裂解可以得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | 若物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com