
����Ŀ�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��1����Ӧ��2H2SO4��l��=2SO2��g��+O2��g��+2H2O��g�� ��H=+550 kJ��mol-1
����������Ӧ�����i. H2SO4��l��=SO3��g��+H2O��g�� ��H=+177 kJ��mol-1 ii. SO3��g���ֽ⡣
L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��ii��SO3��g����ƽ��ת������X�ı仯��ϵ��

�� X��������������_____________________��
�� �ж�L1��L2�Ĵ�С��ϵ��______________��
��2����Ӧ��I��������Ϊ���������ܵĴ��������¡�
i. SO2+4I��+4H+=S��+2I2+2H2O�� ii. I2+2H2O+ SO2= SO42��+4H++2I����
̽��i��ii��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mL SO2������Һ���뵽2 mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
��� | A | B | C | D |
�Լ���� | 0.4 mol/L KI | a mol/LKI 0.2 mol/LH2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 0.0002 mol I2 |
ʵ������ | ��Һ��ƣ�һ��ʱ�����ֻ��� | ��Һ��ƣ����ֻ��ǽ�A�� | ���������� | ��Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�� |
�� B��A�ĶԱ�ʵ�飬��a=__________��
�� �Ƚ�A��B��C���ɵó��Ľ�����_______________________________��
�� ʵ�������SO2���绯��Ӧ����D��A�����i��ii��Ӧ���ʽ���ԭ��___________��
��3�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ����SO2�Ĺ����У�pH��n��SO32-��:n��HSO3�����仯��ϵ���±���
n��SO32����:n��HSO3���� | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�

�� �ϱ��ж�NaHSO3��Һ��__________�ԣ��û�ѧƽ��ԭ�����ͣ�_____________����
�� HSO3���������ŵ�ĵ缫��Ӧʽ��______��������������ҺpH����8����ʱ������Һ������ѭ�����á���������ԭ��________��
���𰸡�ѹǿL2 >L10.4I��SO2�绯��Ӧ�Ĵ�����H+��������ʱ�����д����ã���H+���Լӿ��绯��Ӧ���ʷ�Ӧii��i�죻D���ɷ�Ӧii������H+ʹ��Ӧi�ӿ졣��HSO3������HSO3��H++SO32����HSO3��+H2OH2SO3+OH����HSO3���ĵ���̶ȴ���ˮ��̶ȡ�HSO3��+H2O��2e��=SO42��+3H+�������������õ���������������Һ��������Ũ�Ƚ��ͣ���ʹHSO3����������SO32�����������ӽ��������ң�����Һ�Ϳ���������
��������
��1���ɸ�˹���ɵó��Ȼ�ѧ��Ӧ����ʽ2SO3(g)=2SO2(g)+O2(g)��H=+196kJ��mol-1��
�ٸ÷�Ӧ����ӦΪ�����������ķ�Ӧ��ѹǿ����ƽ�������ƶ���SO3��ת���ʼ�С��X������������Ϊѹǿ��
�ڸ��ݢ��ʿ�֪L������������Ϊ�¶ȣ��÷�Ӧ������ӦΪ���ȷ�Ӧ����ͬѹǿʱ���¶����ߣ�ƽ�������ƶ���SO3��ת��������L2��L1��
��2����B��A�ĶԱ�ʵ�飬����ʵ�����������Ƿ��������һ�������������м���KI��Ũ��Ӧ��ͬ����Ϊ0.4mol/L��
��I��SO2�绯��Ӧ�Ĵ�����H+��������ʱ�����д����ã���H+���Լӿ��绯��Ӧ����;C��ʵ��������˵������ܴ��÷�Ӧ�Ľ��У���A��B����ʵ������Ƿ�������һ����������B�г������ֽ�A�죬˵������ͬ�����£����������ɼӿ췴Ӧi�����ʡ�
��3���ٸ��ݱ��е�����n��SO32����:n��HSO3����=1:91ʱ����Һ��pHΪ���ԣ��ɴ˿�֪��NaHSO3Ϊ���ԣ�HSO3������Һ�У��ᷢ��������ˮ������HSO3��H++SO32����HSO3��+H2OH2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԣ�
�ڸ���ͼ�е�����ʾ��HSO3���������ŵ�ĵ缫����ʽΪ��HSO3��+H2O��2e��=SO42��+3H+�����������У�H+�õ�������H2������H+Ũ�ȵĽ��ͣ���ҺpH�����ɴ�ʹHSO3����������SO32������Na+���������ң�����Һ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�ΪTʱ����2.0 L�����ܱ������г���1.0 molA��1.0 molB��������ӦA(g)��B(g)![]() C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
��1����Ӧǰ5 s��ƽ����Ӧ����v(A)��____________��
��2���¶�ΪTʱ���ﵽƽ���B���ʵ�����Ũ�ȣ�________��
��3�������¶ȣ�ƽ��ʱc(A)��0.41 mol��L��1����Ӧ�Ħ�H_______0���������������
��4�����д�ʩ������Ӧ���ʣ���ƽ��������Ӧ�����ƶ���__________��
a����ʱ�����A���� b���ʵ������¶� c������B��Ũ�� d��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��ӦA(g����3B(g��![]() 2C(g����2D(g���������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ����
2C(g����2D(g���������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ����
�ֱ����£����з�Ӧ������������ ��
A��v(C����0.04 mol/(L��s��
B��v(B����0.06 mol/(L��min��
C��v(A����0.15 mol/(L��min��
D��v(D����0.01 mol/(L��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��Һ�������һ�����͵绯ѧ����װ��(����ͼ��ʾ)�����ҺΪ�廯пˮ��Һ�����Һ�ڵ���ʴ��͵�ؼ䲻��ѭ��������˵����ȷ����( )
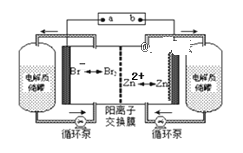
A. ���ʱ�����ĵ缫��ӦʽΪ��Br2+2e-=2Br-
B. �ŵ�ʱÿת��2mol���ӣ���������������65��
C. �ŵ�ʱ������ʴ����е�������Ũ������
D. �����b�ӵ�Դ��������Zn2+ͨ�������ӽ���Ĥ����������Ҳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Fe2(SO4)3��Һʱ��Ϊ�˷�ֹˮ�⣬��������Һ�м���������
A.NaOHB.H2SO4C.KClD.CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���е�����ֲ���к���ȩ��������Щ����������ζ������Ϊֲ������ʹ�ã������Ƥ�����ȩ��![]() �������ʺ�����ȩ��
�������ʺ�����ȩ��![]() ��������˵����������
��������˵����������
A. ���ȩ�ܷ����ӳɷ�Ӧ��ȡ����Ӧ�ͼӾ۷�Ӧ
B. ��������������ͭ����Һ�������ȩ�����еĺ���������
C. ���ȩ�ͱ���ȩ��Ϊͬϵ��
D. ����ȩ����������ԭ�ӿ���λ��ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���G(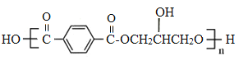 )��һ����Ҫ���л��߷��Ӳ��ϣ�ʵ�������л���A�Ʊ�G��һ�ֺϳ�·�����£�
)��һ����Ҫ���л��߷��Ӳ��ϣ�ʵ�������л���A�Ʊ�G��һ�ֺϳ�·�����£�

�ش��������⣺
��1��D��������________B�����к��еĹ����ŵ�������___________________________��
��2��A��B��B��C�ķ�Ӧ���ͷֱ�Ϊ_____________________��_________________________��
��3������˵����ȷ����_____________________������ĸ��ţ���
a��A���Ӵ���˳���칹
b��������NaHCO3����D��F
c��E�����������14��ԭ��λ��ͬһƽ����
��4��д��D+F��G�Ļ�ѧ����ʽ________________________��
��5��H��F��ͬϵ�����Է���������F��28��H�ĺ˴Ź�������������壬�������Ϊ3�U1�U1������ϸ�������H��ͬ���칹�干��______�֣�д������H��һ�ֽṹ��ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ��������ˮ�������л��ܼ������壬������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ijͬѧ��ʵ��������ȡClO2����̽�������ʡ��ش��������⣺
��.ClO2���Ʊ�
ʵ�����Ʊ�ClO2�ķ�Ӧԭ��Ϊ2NaClO2 �� Cl2 = 2ClO2 �� 2NaCl��װ������ͼ��ʾ��

��1��װ��A��ƿ�з�����Ӧ�����ӷ���ʽΪ___________________________��
��2��װ��B��ʢ�ŵ�����Լ�Ϊ________(����ĸ����)��
a.NaOH��Һ ��b.Ũ���ᡡ c.����ʳ��ˮ�� d.CCl4 e.����ʯ��ˮ
��3�����Ƶμ�Ũ��������ʣ�ʹ���������建��ͨ��װ��D����Ŀ����______________________________________________________________��
��.̽��ClO2��������,����ͼ��ʾװ�ý���ʵ�飺

��4��������б����еĿո�
ϴ��ƿ | ��������� | ����ԭ�� |
X | ��Һ��dz��ɫ����ػ�ɫ | ��Ӧ�����ӷ���ʽΪ_________________ |
Y | ��Һ�г��ֵ���ɫ���� | ��Ӧ�����ӷ���ʽΪ______________ |
Z | NaOH��Һ��������________________________ | ��Ӧ�Ļ�ѧ����ʽΪ 2NaOH �� 2ClO2 = NaClO2 �� NaClO3 �� H2O |
��.�ⶨˮ�е�Ũ��
�õ������ⶨˮ��ClO2Ũ�ȵ�ʵ�鲽�裺ȡ100 mL��ˮ����ϡ�������pH��2��3������һ������KI��Һ��������ټ��뼸��ָʾ������2.0��10��4 mol/L��Na2S2O3��Һ���еζ�(��֪��2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O ��2S2O32�� �� I2 = S4O62�� �� 2I�� )��
��5�����ﵽ�ζ��յ�ʱ������15.00 mL ��Na2S2O3��Һ����ˮ����ClO2��Ũ���� _________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��Һ��ֻ����OH����H����NH4����Cl���������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳��������������ֹ�ϵ��
��c(Cl��)>c(NH4��)>c(H��)>c(OH��) ��c(NH4��)>c(OH��)>c(Cl��)>c(H��)
��c(NH4��)>c(Cl��)>c(OH��)>c(H��) ��c(Cl��)>c(H��)>c(NH4��)>c(OH��)
��д���пհף�
��1������Һ��ֻ����һ�����ʣ����������______��������������Ũ�ȵĴ�С˳��Ϊ________(�����)��
��2�����������ӵĹ�ϵ���Ϣۣ�������Ϊ____________________________��
���������ӵĹ�ϵ���Ϣܣ�������Ϊ____________________________��
��3����pH��ͬ��NH4Cl��Һ��HCl��Һϡ����ͬ�ı�����������ͼ����ȷ����________(��ͼ�����)��

��4��������Һ���������ȵ�ϡ����Ͱ�ˮ��϶��ɣ���ǡ�ó����ԣ�����ǰc(HCl)________c(NH3��H2O)(����ڡ�����С�ڡ����ڡ�����ͬ)�����ǰ����c(H��)�ͼ���c(OH��)�Ĺ�ϵΪc(H��)________c(OH��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com