
【题目】有机物A是一元羧酸,由C,H,O元素组成,质量分数:C%40%;H 6.67%;取0.60g A配成溶液,用含0.01mol NaOH 的溶液能恰好完全中和.
(1)A的最简式为;最简式量为 .
(2)A的相对分子质量为;分子式为 .
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】在无色透明的溶液中,能够大量共存的离子组是
A. Al3+、Ca2+、Cl-、NO3- B. Ba2+、K+、CO32-、Cl-
C. Na+、Cu2+、NO3-、HCO3- D. Na+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:
(1)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是___________。
(2)分子X的电子式是__________;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式_________________________________。
(3)实验证明,熔融的EF3 不导电,其原因是_______________________。
(4)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以E(CA)4- 的形式存在,写出E溶于Z溶液的离子方程式:_____________________。
(5)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
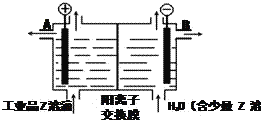
①该电解槽的阳极反应式是_________________。
②通电开始后,阴极附近溶液pH___________(“增大”、“减小”或“不变”)。
③除去杂质后的Z溶液从液体出口_________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,
最后再用蒸馏,水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.
请填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,如何混合? .
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是;
(3)装置中常在试管上连接玻璃管,作用是什么? .
(4)步骤④中洗涤、分离粗硝基苯应使用的仪器是 .
(5)步骤④中粗产品用5% NaOH溶液洗涤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A.金属钠投入蒸馏水2 Na+2H2O=2 Na+ +2OH- +H2↑
B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+ =SO2↑+ H2O
C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑
D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4 g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150 mL某浓度的盐酸中,充分反应后生成CO2 4.48 L(已折算成标准状况下),所得溶液稀释至250 mL,测得溶液的c(H+)=0.100 mol·L-1。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=________mol·L-1。
(2)x∶y∶z=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com