
【题目】下列指定反应的离子方程式正确的是
A. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铜丝插入Fe2(SO4)3溶液中:Cu +Fe3+ =Cu2+ +Fe2+
C. 向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—
【答案】D
【解析】
A.Cl2与H2O的反应生成的HClO酸是弱酸,发生反应的离子方程式为Cl2+H2O![]() H++Cl-+HClO,故A错误;
H++Cl-+HClO,故A错误;
B.铜丝插入Fe2(SO4)3溶液中发生反应的离子方程式为Cu +2Fe3+ =Cu2+ +2Fe2+,故B错误;
C.向FeBr2溶液中通入过量Cl2,Fe2+也能被氧化为Fe3+,发生反应的离子方程式为2Fe2++4Br-+3Cl2= 2Fe3++2Br2+6Cl-,故C错误;
D.向Na2SiO3溶液中通入过量CO2生成硅酸沉淀和碳酸氢钠,发生反应的离子方程式为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—,故D正确;
故答案为D。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】“元素化合价—物质的类别”二维图清晰的体现了物质分类及转化的情况。请根据硫元素相关二维图回答问题。

(1)X的电子式为__,气态氢化物稳定性:H2O__x(填“>”、“=”或“<”)
(2)熔融态下物质Z__导电(填“可以”或“不可以”),酸性强弱:___H3PO4(填“>”、“=”或“<”)。
(3)将X与Y混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__。
(4)实验室中物质T有少量变质为Na2SO4,设计简单的实验方案予以验证___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是某些有机反应的催化剂,某校学习小组用下面装置制备少量AlCl3。
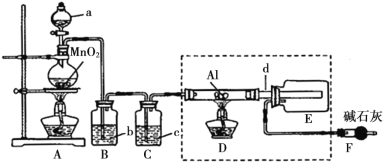
已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
(1)a仪器的名称为____________________;A装置中反应的化学方程式为_______________。
(2)试剂b为_____________________。
(3)所用d导管较粗的原因是______________________。
(4)F装置的作用为________________。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_________;用离子方程式表示E中的现象变化_______。
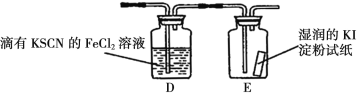
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: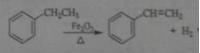 ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
以芳香族化合物A和有机物D为原料,制备有机物M和高聚物N的一种合成路线如下:
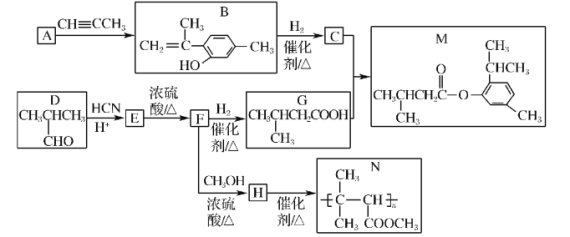
已知:I.A→B的原子利用率为100%。
Ⅱ.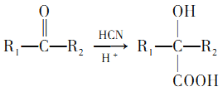 (R1、R2表示氢原子或烃基)。
(R1、R2表示氢原子或烃基)。
请回答下列问题:
(1)A的结构简式为___________。
(2)D的化学名称为___________。
(3)F→H的反应类型为___________。
(4)C+G→M的化学方程为______________________。
(5)同时满足下列条件的B的同分异构体有___________种(不考虑立体异构)。
①苯环上连有两个取代基;②能发生银镜反应。
(6)参照上述合成路线和信息,以乙烯为原料(无机试剂任选),设计制备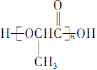 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:
[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
(5)Zn与S形成某种化合物的晶胞如图所示。
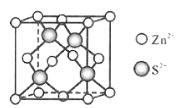
①Zn2+填入S2-组成的___________空隙中;
②已知晶体密度为d g/cm3,该晶胞的边长表达式为______pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
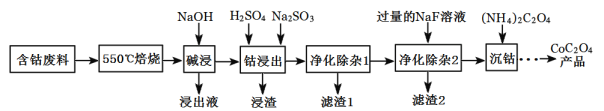
(1)“550℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃加入H2O2溶液,其目的是______。(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是______。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol/L,则滤液中c(Mg2+)为___[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.000g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com