
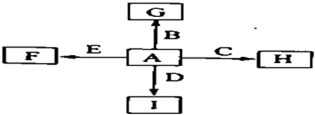
 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:| 高温 |
| ||
| 高温 |
| ||
| 高温 |
| ||
| ||
| ||
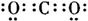 ,
,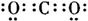 ;直线形;
;直线形;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 由短周期元素组成的常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).若( )
由短周期元素组成的常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).若( )| A、X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应 |
| B、A是单质,B和D的反应是OH-+HCO3-→H2O+CO32-,则E一定能还原Fe2O3 |
| C、X是O2,且C与D摩尔质量相差16,则A一定为Mg3N2 |
| D、D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
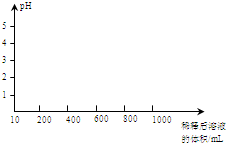 常温下,有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答有关问题:
常温下,有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答有关问题:| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
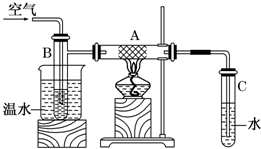 如图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
如图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com