
【题目】向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题: 
(1)图中A点表示的意义是;
(2)图中B点表示的意义是;
(3)假如溶液中生成了沉淀0.39g,则此时用去NaOH溶液的体积最少是 . (写出计算过程)
【答案】
(1)Al3+完全沉淀
(2)Al(OH)3刚好完全溶解
(3)7.5mL或17.5mL
【解析】解:(1)由图像可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,所以答案是:Al3+完全沉淀;(2)由图像可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解,所以答案是:Al(OH)3刚好完全溶解;(3)溶液中有Al(OH)3沉淀0.39g,n= ![]() =0.005mol,存在两种情况,则①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,设此时用去NaOH溶液体积为x,则
=0.005mol,存在两种情况,则①只发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,设此时用去NaOH溶液体积为x,则 ![]() =0.0075L=7.5mL,②若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,则
=0.0075L=7.5mL,②若发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,则 ![]()
=0.0175L=17.5mL,
所以答案是:7.5mL或17.5mL.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是恒温下某反应的化学反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( ) 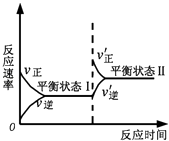
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 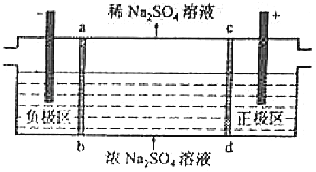
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料. 已知:
①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1
②CH4(g)+ ![]() O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJmol﹣1
(1)氢气的燃烧热为 , 写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是 . 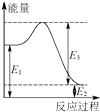
A.E1=36kJ B.E2=36kJ C.E1﹣E2=36kJ D.E3﹣E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能 | 348 | 413 | 436 | 358 | 1072 | 463 |
则△H1= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法, 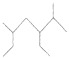 的名称为2﹣甲基﹣3,5﹣二乙基己烷
的名称为2﹣甲基﹣3,5﹣二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯和硝基苯四种物质
C.等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加
D.葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可以表示如图的能量变化的是( ) 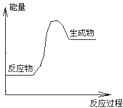
A.Al和Fe2O3的铝热反应
B.Ba(OH)28H2O与NH4Cl的反应
C.NaOH溶液与CH3COOH溶液反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+ , 现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( ) 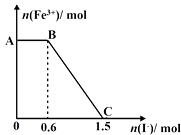
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I﹣═2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.共有1molFeSO4被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 , 微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 . 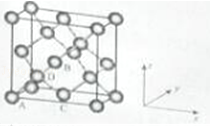
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为 gcm﹣3(列出计算式即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com