
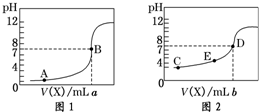
 常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:
常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:分析 如果酸为强酸,则0.10mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性分析;b点氢氧化钠溶液的体积小于20mL,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,E点是酸性,所以c(OH-)<c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再结合电荷守恒判断离子浓度;
解答 解:如果酸为强酸,则0.10mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,盐酸溶液中滴入20.ooml氢氧化钠溶液恰好完全中和,醋酸溶液中滴入的氢氧化钠溶液小于20.00ml,a>b,根据图2知,b点氢氧化钠溶液的体积小于20mL,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,E点是酸性,所以c(OH-)<c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),则溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:图1;盐酸是强酸,0.10mol/L酸的pH为1;>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
点评 本题考查了图象分析,酸碱反应定量关系和溶液酸碱性的理解应用,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 某电中性单核粒子含有6个电子、7个中子,该粒子是${\;}_{6}^{13}$C | |
| B. | 在Na+、O2-、Cl、Cl-四种粒子中,半径最大的是Cl-,半径最小的是Na+ | |
| C. | 在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是A-x+n+24 | |
| D. | 硫离子的结构示意图为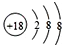 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀硝酸 | 有气体产生,说明样品中含有Na2CO3 |
| ② | 向试管中加入足量Ba(NO3)2溶液 | 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4 |
| ③ | 若②操作无沉淀,则向试管中加入0.1mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1mol•L-1AgNO3溶液 | 有沉淀产生,则含NaCl;无沉淀产生,则不含NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中,两个O之间形成2对共用电子对 | |
| B. | N2的电子式是N┇┇N | |
| C. | CO2和CS2都是直线型分子 | |
| D. | 白磷和甲烷都是正四面体型,键角都是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
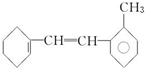 有机物结构简式如下:
有机物结构简式如下: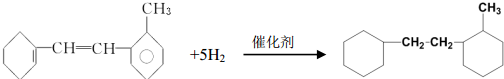 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com