
【题目】(1)往2L密闭容器中充入1molN2和3molH2,在一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气体中NH3的体积分数为25%,则:
①0~2min内,v(NH3)=_________。
②H2在平衡混合气中的体积分数=_________。
③平衡时容器的压强与起始时的压强之比为_________。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
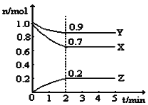
①该反应的化学方程式为_____________。
②2min反应达平衡容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
③上述反应在第2min时,X的转化率为_________
④将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
【答案】0.2mol·L-1·min-1 56.25% 4∶5 3X+Y![]() 2Z 大 相等 30% 5∶3
2Z 大 相等 30% 5∶3
【解析】
(1)运用三段式法,根据反应速率表达式及阿伏伽德罗定律分析解答;(2)根据图示反应过程中各组分的物质的量变化书写方程式,根据转化率表达式进行相关计算。
(1)发生3H2+N22NH3,设参加反应的氮气的物质的量为xmol,则
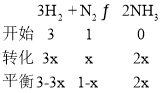
测得平衡混合气中NH3的体积分数为25%,则![]() ,解得x=0.4mol;
,解得x=0.4mol;
① 0~2min内,v(NH3)=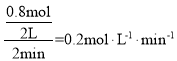 ,故答案为:0.2molL-1min-1;
,故答案为:0.2molL-1min-1;
② H2在平衡时的体积分数为![]() ,故答案为:56.25%;
,故答案为:56.25%;
③ 平衡时容器内的压强与起始时压强之比为![]() ,故答案为:4:5;
,故答案为:4:5;
(2)① 根据图示分析,X和Y是反应物,X、Y、Z的变化量之比是(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,该反应的化学方程式为:3X+Y2Z,故答案为:3X+Y2Z;
② 混合气体的平均相摩尔质量![]() ,从开始到平衡气体的总质量不变,但n逐渐减小,所以2min反应达平衡容器内混合气体的平均相对分子质量比起始时大;混合气体密度
,从开始到平衡气体的总质量不变,但n逐渐减小,所以2min反应达平衡容器内混合气体的平均相对分子质量比起始时大;混合气体密度![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:大;相等;③ 2min时X的转化率=
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:大;相等;③ 2min时X的转化率=![]() 故答案为:30%;
故答案为:30%;
④ 设反应到某时刻时,Y反应了xmol,则

则a-3x=b-x=2x,解得a=5x,b=3x,则a:b=5:3,故答案为:5∶3。


科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
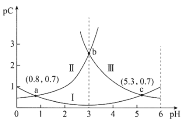
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[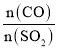 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
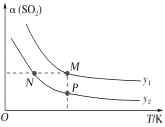
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成CO2和水。将12g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g;再通过碱石灰,碱石灰增重26.4g,该有机物的分子式为( )
A. C4H10OB. C2H6OC. C3H8OD. C2H4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究MnO2与浓盐酸的反应,用如图所示的装置进行实验。
(1)B是用来收集气体的装置,但未将导管画全,请在装置图中将导管补画完整。_________
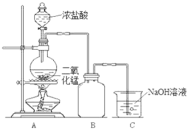
(2)制备实验开始时,先检查装置气密性,接下来的操作依次是_________(填字母)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中滴加浓盐酸
(3)实验中该同学取8.7g MnO2和50mL 12mol/L浓盐酸在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有固体剩余,该同学还检测到有一定量的盐酸剩余。
①MnO2与浓盐酸反应的化学方程式为_________。
②为什么有一定量的盐酸剩余但未能使MnO2完全溶解?_________。
③下列试剂中,能证明反应停止后烧瓶中有盐酸剩余的是_________(填字母)。
A.硝酸银溶液 B.碳酸钠溶液 C.氯化钠溶液
(4)为了测定反应残余液中盐酸的浓度,该同学设计了两个实验方案:
方案一:将A中产生的气体缓缓通过已称量的装有足量NaOH溶液的洗气瓶,反应停止后再次称量,两次质量差即是Cl2的质量,据此可求剩余盐酸的量。
方案二:当MnO2与浓盐酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生H2的体积为V L(已换算为标准状况下)。
①实际上方案一不合理,原因为_________。
②根据方案二,写出剩余盐酸的物质的量浓度的计算式(假设反应前后溶液的体积保持不变)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
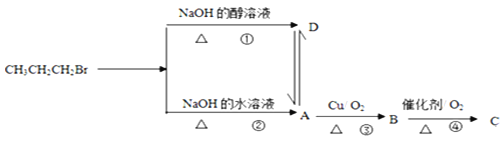
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式:
SO2(g)+NH3H2O(aq)=NH4HSO3(aq) △H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol﹣1。
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。
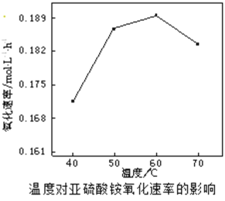
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K=________.[已知Ksp(CaCO3)=2.9×10﹣9,Ksp(CaSO4)=9.1×10﹣6]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com