
【题目】金属铝分别和O2、O3反应生成Al2O3,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。下列有关说法中不正确的是
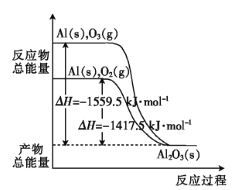
A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH=-1559.5kJ·mol-1
B. 等质量的O2比O3的能量低,O2比O3稳定
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2835kJ·mol-1
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10mL 1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是:
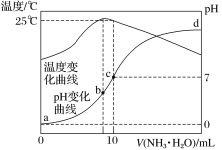
A.a点Kw=1.0×10-14
B.水的电离程度:c > b >a>d
C.b点:c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数Kh= ![]() mol·L-1 (用含n的代数式表示)
mol·L-1 (用含n的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
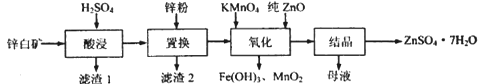
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为a和b,则a与b的关系为( )
A. a>b B. a=10﹣4b C. b=10﹣4a D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古语说:“人要实,火要虚。”此话的意思是做人要脚踏实地,才能事业有成;可燃物燃烧要架空一些,才能燃烧更旺。“火要虚”的目的是
A. 降低可燃物的着火点 B. 增大空气中氧气的含量
C. 升高可燃物的着火点 D. 增大可燃物与氧气的接触面积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)开始进行时, c(NH3)=0.04mol/L,经5min后,c(NH3)=0.03mol/L,则v(NH3)为
A. 0.002mol/(L·min) B. 0.001mol/(L·min)
C. 0.003mol/(L·min) D. 0.002mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com