
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
【答案】B
【解析】
由图可知,传感器中发生4AlI3+3O2═2Al2O3+6I2,原电池反应为2Ag+I2=2AgI,所以原电池的负极发生Ag-e-=Ag+,正极发生I2+2Ag++2e-=2AgI,充电时,阳极与外加电源正极相接、阴极阴极与外加电源负极相接,反应式与正极、负极反应式正好相反
A.原电池正极电极反应为I2+2Ag++2e-=2AgI,故A错误;
B.由题中信息可知,传感器中首先发生①4AlI3+3O2═2Al2O3+6I2,然后发生原电池反应②2Ag+I2=2AgI,①+3②得到总反应为3O2+4AlI3+12Ag═2Al2O3+12AgI,故B正确;
C.没有指明温度和压强,无法计算气体体积,故C错误;
D.给传感器充电时,Ag+向阴极移动,即向Ag电极移动,故D错误;
故选B。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
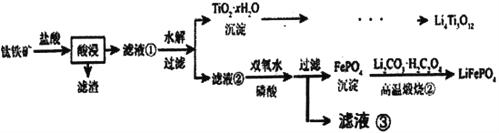
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]与pH的变化关系如图所示。下列说法一定正确的是( )

A. Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系
B. pH=1.22的溶液中:2c(C2O42﹣)+c(HC2O4﹣)>c(Na+)
C. 1.22<pH<4.19的溶液中:c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D. pH=4.19的溶液中:c(Na+)=3c(HC2O4﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯在NaBH4、ZnCl2等作用下可转化为醇,其中NaBH4转化为H3BO3:

(1)Zn2+基态核外电子排布式为_____。
(2)苯甲醇(![]() )中碳原子的杂化轨道类型为_____。
)中碳原子的杂化轨道类型为_____。
(3)1mol苯甲酸甲酯(![]() )分子中含有σ键的数目为_____mol。
)分子中含有σ键的数目为_____mol。
(4)与BH4﹣互为等电子体的阳离子为_____(填化学式),BH4﹣离子的空间构型为(用文字描述)_____。
(5)硼酸是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。1molH3BO3晶体中有_____mol氢键。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
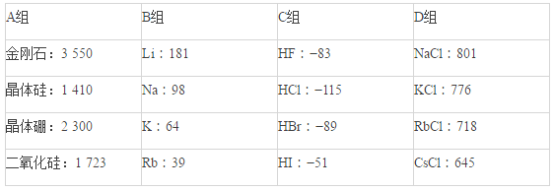
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH﹣)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH﹣)=KW
B. M区域内任意点均有c(H+)<c(OH﹣)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)Cr3+电子排布式为______________________,基态Si原子中,电子占据的最高能层符号为______________________。
(2)翡翠中主要成分为硅酸铝钠,四种元素的第一电离能由大到小的顺序___________。
(3)锰的一种化合物的化学式为Mn(BH4)2(THF)3,THT的结构简式如图所示:

①THF中C原子的杂化轨道类型为___________,②BH4-的空间构型为___________
③NaBH4所含化学键类型有_____________
A、离子键 B、共价键 C、氢键 D、配位键
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,原因______________________。
(5)Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷,x为0.88,且晶体中Ni的存在形式为Ni2+、Ni3+,则晶体中N i2+和Ni3+最简整数比为___________,该晶体的晶胞参数为428pm,则晶体密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____________________________。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):________________________________________________________________________________________________________________________________________________;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:_________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸目的是________________________________________。若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为___________________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) ![]() Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com