
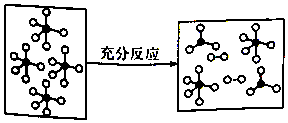
 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为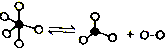 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
分析 A、根据图示可知,是一个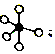 失去可2个“o”从而生成了
失去可2个“o”从而生成了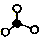 和
和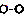 ;
;
B、PCl5分解为PCl3和氯气;
C、化学反应的实质是旧键的断裂和新键的形成;
D、分解反应不一定吸热.
解答 解:A、根据图示可知,是一个 失去可2个“o”从而生成了
失去可2个“o”从而生成了 和
和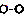 ,且
,且 没有完全反应,故此反应为可逆反应,反应可以表示为
没有完全反应,故此反应为可逆反应,反应可以表示为 ,故A正确;
,故A正确;
B、PCl5分解为PCl3和氯气,化学方程式为PCl5?PCl3+Cl2,和图示反应符合,故图示的反应可能为PCl5的分解反应,故B正确;
C、化学反应的实质是旧键的断裂和新键的形成,故此反应中一定伴随着旧键的断裂和新键的形成,故C正确;
D、分解反应大多数吸热,但不一定,故此反应的△H不一定大于0,故D错误.
故选D.
点评 本题考查化学反应、可逆反应等,为高频考点,把握图中分子的变化、常见的反应为解答的关键,侧重分析与应用能力的考查,注意判断参加反应的分子数目,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
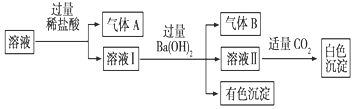 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeSO4在空气中放置变质 | B. | 氯水、AgI密封保存在棕色试剂瓶中 | ||
| C. | 乙烯使溴水和酸性KMnO4溶液褪色 | D. | 常温下浓硝酸不能溶解Al和Au(金) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
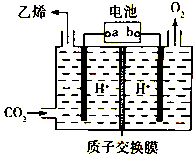 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将碳酸氢钠分解产生的气体通入CaCl2溶液 | 产生白色沉淀 | CO2与CaCl2溶液反应 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将水蒸气通过灼热的铁粉 | 有黑色晶体生成 | 铁与水在高温下发生反应 |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为浅色蓝色沉淀 | Mg(OH)2的溶度积(Ksp)比Cu(OH)2小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com