
【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2气密性的检验检验有H2生成Fe如果有铁粉剩余,也会将溶液中Fe3+转变成Fe2+Fe3O4+8H+=2Fe3++Fe2++4H2O
Fe3O4+4H2气密性的检验检验有H2生成Fe如果有铁粉剩余,也会将溶液中Fe3+转变成Fe2+Fe3O4+8H+=2Fe3++Fe2++4H2O
【解析】
(1)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2 ,方程式为: 3Fe+4H2O(g)![]() Fe3O4+4H2;因此,本题正确答案: 3Fe+4H2O(g)
Fe3O4+4H2;因此,本题正确答案: 3Fe+4H2O(g)![]() Fe3O4+4H2 。
Fe3O4+4H2 。
(2)实验前必须对整套装置进行气密性检查;因此,本题正确答案是: 气密性的检验。
(3) ①能够把肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说明有氢气生成,即作用是检验反应中生成氢气;正确答案:检验有H2生成。
②与盐酸反应有气泡冒出说明含有铁;不能确定是否含有Fe3O4或FeO,铁与盐酸反应生成了氯化亚铁,如果混合物中存在Fe3O4,溶于盐酸生成的 Fe3+与Fe反应生成了Fe2+;正确答案: Fe;如果有铁粉剩余,也会将溶液中Fe3+转变成Fe2+。
③四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,反应的化学方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;正确答案:Fe3O4+8H+=2Fe3++Fe2++4H2O。


科目:高中化学 来源: 题型:
【题目】已知在相同状况下,使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )
A. 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B. 化合反应一定是放热反应
C. 相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2一定是一个吸热反应
D. 分解反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是
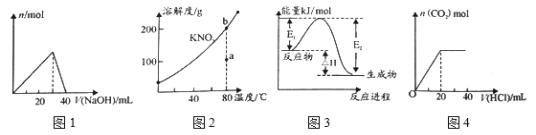
A. 图1表示向l00mL0.l mol·L-l的A1Cl3溶液中滴加1 mol·L-1的NaOH溶液时n [Al(OH)3]的变化情况
B. 图2表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C. 图3表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变
D. 图4表示向Na2CO3溶液中滴加稀盐酸时,产生n(CO2)的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.1mol/L AlCl3溶液中,加入1mol/L NaOH溶液v mL后,再滴加1mol/L盐酸。滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如图示的关系,则加NaOH溶液的体积为( )

A. 10mL B. 30mL C. 40mL D. 50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是
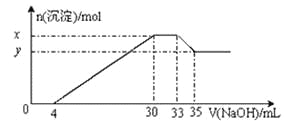
A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为______________________。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
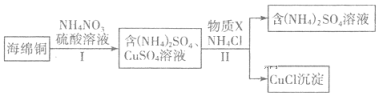
①步骤I中反应温度不宜过高的原因是______,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 ______________。
②步骤Ⅱ中物质X可选用____(填字母),该物质需过量的原因,其一是加快反应速率,其二是____________。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 摩尔是国际单位制中的七个物理量之一 B. 0.5 mol H2O中含有的原子数目为1.5NA
C. 64 g氧相当于2 mol氧 D. 1 mol任何物质都约含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下。

下列说法不正确的是
A. 过程i发生了加成反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D. 该合成路线理论上碳原子100%利用,最终得到的产物易分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。

①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O![]() 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com