��2011?������ģ�⣩ij�����������������þ����ȼ��������ʯ��CaCO
3?MgCO
3��Ϊԭ��ұ��þ���������������ɵ��������ڻ�ԭ¯�о�1200���ù�����ԭ����þ�����������ϼ۲��䣩��þ����������Ϊ��þ��ͬʱ�Ժ�ˮΪԭ���Ƽ������ȼ���������������£�
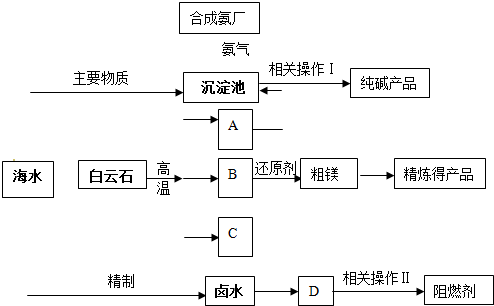
��1���ֱ�д��A��B��C�Ļ�ѧʽ
CO2
CO2
��
MgO
MgO
��
CaO
CaO
���������з�Ӧ�Ļ�ѧ����ʽ��
CO2+NH3+NaCl+H2O��NaHCO3��+NH4Cl
CO2+NH3+NaCl+H2O��NaHCO3��+NH4Cl
��
��2��������ԭ����þ����ʱѡ���ѹ��1200�棬�Է���ѡ�����ַ�Ӧ������ԭ��
��ѹ������þ���������ɼ����룻1200��ֻ��þΪ���壬�����ʺ�ƽ��2���Ƕȶ�������þ������
��ѹ������þ���������ɼ����룻1200��ֻ��þΪ���壬�����ʺ�ƽ��2���Ƕȶ�������þ������
��
��3������±ˮ�е�MgCl
2������ʯ���鷴Ӧ���ɼ�ʽ�Ȼ�þ[Mg��OH��Cl]��������ʱ��Һ����Ҫ�����ǣ�д��ѧʽ��
CaCl2
CaCl2
��
��4��������������ز�����������ˡ�
ϴ��
ϴ��
��
���գ�����ȣ�
���գ�����ȣ�
��
��5����֪��Mg��OH��
2��s����MgO��s��+H
2O��g��-81.5kJ��
Al��OH��
3��s����0.5Al
2O
3��s��+1.5H
2O��g��-87.7kJ
��Mg��OH��
2������ȼ���ã���ԭ����
Mg��OH��2���ȷֽ�ʱ���մ�������ʹ�����¶��½���ͬʱ���ɵ����¡��ȶ��Ժõ�MgO�������ڿ�ȼ����棬������ȼ����
Mg��OH��2���ȷֽ�ʱ���մ�������ʹ�����¶��½���ͬʱ���ɵ����¡��ȶ��Ժõ�MgO�������ڿ�ȼ����棬������ȼ����
��
�ڵ�����Mg��OH��
2��Al��OH��
3��ȣ���ȼЧ���Ϻõ���
Mg��OH��2
Mg��OH��2
��
��6��ij������������ͼ��ʾ���������������þ����ȼ�����Է������������ŵ�
ԭ���ü�����ԭ�������ʸߡ��м��������Ч��ѭ�����á���Ʒ�ṹ�Ķ�����
ԭ���ü�����ԭ�������ʸߡ��м��������Ч��ѭ�����á���Ʒ�ṹ�Ķ�����
��

 ��������ϵ�д�
��������ϵ�д�

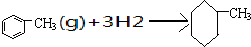 ���ʱ�
���ʱ�