
| 5.0×10-2mol |
| 1.0mol/L×0.005L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
| ||
| ||
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
两个研究性学习小组分别根据不同的微型课题进行研究,其方案如下:

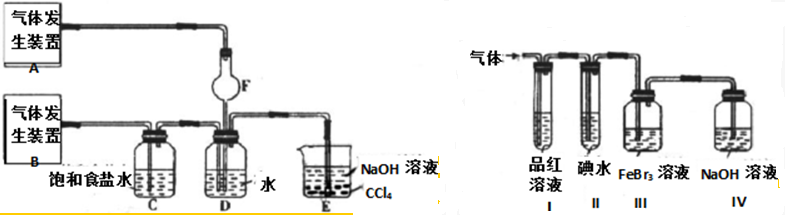
Ⅰ.第一个研究性学习小组用如图所示的装置进行镁与二氧化硫反应的实验。
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:______________________。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体
G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁有淡黄色固体粉末产生,取反应后B中固体溶于稀盐酸中产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式:______________________。
(3)你认为该装置是否有不足之处?______________。如果有,请写出改进方法:______________________________。
Ⅱ.第二个研究性学习小组进行了“实验室制硅”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用木炭粉还原二氧化硅可制得硅 ②镁在点燃条件下即可与二氧化硅反应 ③金属硅化物与稀硫酸反应生成硫酸盐与硅烷 ④硅和二氧化硅均不与稀硫酸反应 ⑤硅烷在空气中能自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制硅”的化学方程式是_________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;镁和钠的化学性质也有一定的相似性。
两个研究性学习小组分别根据不同的微型课题进行研究,其方案如下:

Ⅰ.第一个研究性学习小组用如图所示的装置进行镁与二氧化硫反应的实验。
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:______________________。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体
G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁有淡黄色固体粉末产生,取反应后B中固体溶于稀盐酸中产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式:______________________。
(3)你认为该装置是否有不足之处?______________。如果有,请写出改进方法:______________________________。
Ⅱ.第二个研究性学习小组进行了“实验室制硅”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用木炭粉还原二氧化硅可制得硅 ②镁在点燃条件下即可与二氧化硅反应 ③金属硅化物与稀硫酸反应生成硫酸盐与硅烷 ④硅和二氧化硅均不与稀硫酸反应 ⑤硅烷在空气中能自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制硅”的化学方程式是_________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:计算题
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题:

(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
|
实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
铵盐的质量(g) |
9.88 |
19.76 |
29.64 |
49.40 |
|
浓硫酸增加的质量(g) |
m |
m |
1.36 |
0 |
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为 的实验中,氢氧化钠足量,铵盐中的铵根离
子完全转化成气体;m的值为 。
②计算样品B中氮元素的质量分数。(用小数表示,保留两位小数)
(1)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系。假设样品的质量为x(g),浓硫酸增重的质量为y(g)。求:当x在不同范围时y与x的函数关系。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com