
| A、①②③④ | B、③④①② |
| C、④①③② | D、②①④③ |


科目:高中化学 来源: 题型:
 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:
| a(g) | 起始读数(mL) | b(mL) | c(mL) |
| 0.1970 | 0.00 | 31.30 | 42.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
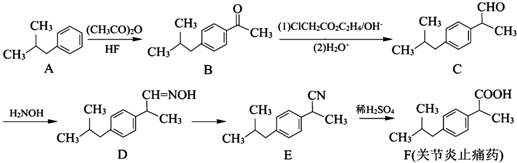
 ,其合成路线如下:
,其合成路线如下:
 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2 的反应得到
的反应得到 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
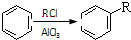 ②
②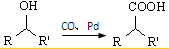 (R、R′表示烃基)
(R、R′表示烃基)| HBr |
| NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量稀HNO3酸化的AgNO3溶液 |
| B、先加入足量BaCl2溶液,过滤,再加入AgNO3溶液 |
| C、先加入足量稀H2SO4,再加入AgNO3溶液 |
| D、先加入稀盐酸,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
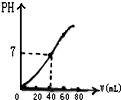 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点对应的沉淀只有BaSO4 |
| B、c点溶液铝元素以AlO2- 的形式存在 |
| C、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com