
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH )>c(Cl)>c(Na)>c(OH)>c(H)
)>c(Cl)>c(Na)>c(OH)>c(H)
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na)+ c(H)=c(S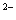 )+ c(HS)+ c(OH)
)+ c(HS)+ c(OH)
D.同物质的量浓度的下列溶液中,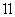 NH4Al(SO4)2、
NH4Al(SO4)2、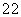 NH4Cl、
NH4Cl、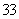 CH3COONH4、
CH3COONH4、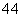 NH3·H2O;c(NH
NH3·H2O;c(NH )由大到小的顺序是:
)由大到小的顺序是: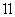 >
>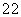 >
>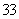 >
>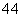
【知识点】电离与水解、离子浓度大小比较
【答案解析】D 解析:A、同温度同物质的量浓度时,HF比HCN易电离,则NaF比NaCN溶液的水解程度小,NaF溶液的pH比NaCN溶液小,故A错误;
B、物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后恰好生成氨水和氯化钠,溶液呈碱性,c(Cl)=c(Na)>c(OH)>c(NH )>c(H),故B错误;
)>c(H),故B错误;
C、电荷守恒:c(Na)+ c(H)=2c(S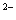 )+ c(HS)+ c(OH),故C错误;
)+ c(HS)+ c(OH),故C错误;
D、铵根水解,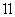 铝离子抑制铵根水解、
铝离子抑制铵根水解、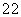 无影响、
无影响、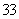 CH3COO-促进铵根水解、
CH3COO-促进铵根水解、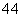 NH3·H2O电离出少量铵根;c(NH
NH3·H2O电离出少量铵根;c(NH )由大到小的顺序是:
)由大到小的顺序是: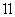 >
>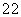 >
>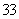 >
>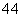 ,故D正确;
,故D正确;
故答案选D
【思路点拨】本题考查离子浓度大小比较知识,主要是弱电解质的电离、盐类水解,注意电荷守恒思想在溶液中的重要应用。


科目:高中化学 来源: 题型:
在一次夏令营活动中,同学们发现了一个深洞,打算进去看看,但洞内很黑,有人提议用手电筒照明,有人说用火把照明。根据所学的化学知识从安全角度考虑,你赞同哪种提议?请阐述理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
玫瑰花中含有香茅醇、橙花醇和丁香油酚等物质;请计算:
(1)丁香油酚(C10H12O2)的相对分子质量为 ;(2)丁香油酚中碳、氢、氧三种元素的质量比 ;
(3)丁香油酚中碳元素的质量分数 (结果精确到0.1%);
(4)16.4g丁香油酚中含 g氧元素(结果精确到0.1g).
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关生活中的化学,说法不正确的是 ( )
A. 石油裂解、煤的气化、海水制镁都包含化学变化来源
B. 福尔马林可制备标本是利用了使蛋白质变性的性质
C. 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火
D. 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH=-92.4kJ/mol 。 在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 ;与传统的合成氨的方法比较,该方法的优点是 。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应制备甲醇。
Ⅰ:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)===CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______________。
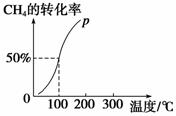 (2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平衡反应速率为____________________。
②100 ℃时反应Ⅰ的平衡常数为__________________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)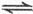 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则下列关系不正确的是
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则下列关系不正确的是
A.4v(NH3)=5v(O2) B.6v(O2)=5v(H2O)
C.3v(NH3)=2v(H2O) D.4v(O2)=5v(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com