
| A. | 反应①配平后,H2O的化学计量数为4 | |
| B. | 若反应②有2mol电子发生转移,则生成1molNO3- | |
| C. | 反应③中生成物X为CO32- | |
| D. | 1L废水完全脱氮所需CH3OH的质量为0.08g |
分析 A、根据电子守恒和电荷守恒配平方程式;
B、根据电子守恒结合反应物产物的量的关系来计算回答;
C、根据电荷守恒和原子守恒来配平方程式;
D、废水中NH4+在微生物作用的条件下脱氮处理转化为氮气,根据反应进行计算即可.
解答 解:A、根据电子守恒和电荷守恒配平方程式为:2NH4++3O2=2NO2-+4H++2H2O,H2O的化学计量数为2,故A错误;
B、反应②2NO2-+O2=2NO3-转移电子是4mol生成2molNO3-,若反应②有2mol电子发生转移,则生成1molNO3-,故B正确;
C、根据电荷守恒和原子守恒得到:6NO3-+5CH3OH+6H+=3N2+5X+13H2O中的X是CO2,故C错误;
D、废水中NH4+在微生物作用的条件下脱氮处理转化为氮气,根据反应③6NO3-+5CH3OH+6H+=3N2+5CO2+13H2ONH4+的浓度为54mg/L,1L废水含有铵根离子是
54mg,即0.054g,根据三个反应得到关系式:2NH4+~2NO3-~$\frac{5}{3}$CH3OH,完全脱氮所需CH3OH的质量为$\frac{\frac{5}{3}×32×0.054}{36}$g=0.08g,故D正确.
故选BD.
点评 本题考查氧化还原反应的配平和计算知识,注意知识的迁移应用是关键,难度中等.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
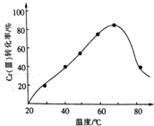 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 相关说法 | 主要原因 |
| A | 包装内放置透气的硅胶包,有利于防止食品变质 | 硅胶有强吸水性 |
| B | 面粉加工车间悬挂有“严禁烟火”的牌子 | 烟火会污染面粉 |
| C | 某些铁制品出厂时在其表面涂上一层油膜可防止其生锈 | 铁被氧化,在其表面形成一层致密的保护膜 |
| D | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
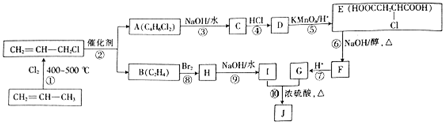
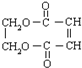 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
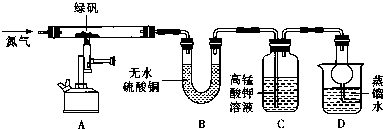
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
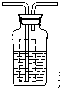 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com