
分析 (1)反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价由+2→+3,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,只有O元素的化合价降低,计算参加反应氧气物质的量,根据O元素化合价变化计算转移电子;
(2)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应.
①若X为氧化物,则X是 Al2O3;
②若X为单质,则X为Al,与NaOH溶液反应生成偏铝酸钠与氢气;
(3)Fe3+具有强氧化性,将碘离子氧化为碘单质,自身被还原为Fe2+;
(4)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价由+2→+3,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,只有O元素的化合价降低,有1.5mol FeS2参加反应,参加反应的氧气为1.5mol×$\frac{8}{3}$=4mol,则转移电子为4mol×2×[0-(-2)]=16mol,即转移电子数目为16×6.02×1023mol-1=9.632×1024,
故答案为:9.632×1024;
(2)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应.
①若X为氧化物,则X是 Al2O3,故答案为:Al2O3;
②若X为单质,则X为Al,与NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Fe3+具有强氧化性,将碘离子氧化为碘单质,自身被还原为Fe2+,反应离子方程式为:2Fe3++2I-═2Fe2++I2,
故答案为:2Fe3++2I-═2Fe2++I2;
(4)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.1L×5mol/L-0.2mol)=0.1mol,
Fe~~~2FeCl3
0.05mol 0.1mol
所以参加反应的铁粉的质量为(0.1mol+0.05mol)×56g/mol=8.4g,
故答案为:8.4g.
点评 本题考查氧化还原反应计算、元素化合物性质、化学方程式计算等,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H+、CO32-、Na+ | B. | Na+、OH-、SO42- | C. | Cu2+、OH-、H+ | D. | Ba2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是
Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是| A. | 铜做阳极、石墨做阴极,石墨电极上产生氧气 | |
| B. | 铜电极发生的反应为:2Cu-2e-+2OH-=Cu2O+H2O | |
| C. | 在电解过程中OH-向石墨电极移动 | |
| D. | 当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| C. | 常温常压下,16gO2与16gO3含有的分了数相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,电离平衡右移,所有离子的浓度均降低 | |
| C. | 反应SiO2(s)3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度大于NH${\;}_{4}^{+}$的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
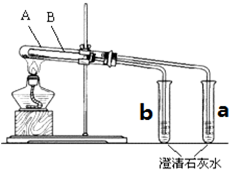 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(CH3COO-) | B. | pH>7 | C. | pH=7 | D. | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com