

分析 (1)凝聚剂具有吸附性,能够吸收水中悬浮颗粒并使之沉降;
(2)次氯酸、臭氧、氯气等具有强的氧化性,能够使蛋白质变性,具有杀菌消毒作用;
(3)根据水污染的原因进行分析,造成水污染的原因有工业废水的任意排放,生活污水的任意排放以及农药化肥的任意施用.
解答 解:(1)沉淀池中需加入凝聚剂(或混凝剂),混凝剂能够吸收水中悬浮颗粒并使之沉降;
故答案为:吸附水中悬浮颗粒并使之沉降;
(2)图中的“加杀菌消毒剂”可以是液氯或臭氧,二者具有强的氧化性,能够使蛋白质变性,具有杀菌消毒作用;
故答案为:液氯或臭氧(O3);氧化性;
(3)①生活污水经处理后排放,不会造成水体污染,故正确;
②不合理使用农药、化肥能够造成水污染,故错误;
③工业生产中废渣的随意堆放,会造成水质的污染,故错误;
④石油运输过程中原油泄露流入江河,能够造成水质的污染,故错误;
故选:①.
点评 本题为生活中常见的化学知识,侧重考查自来水的净化、水体的污染与治理,熟记水污染的途径和防治水污染的方法是解题关键,有利于培养学生珍惜水资源的品质,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
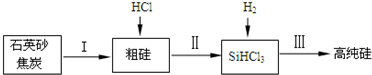
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| C. | 0.5mol/L AlCl3溶液中Cl-的数目为1.5NA | |
| D. | 17g氨气中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
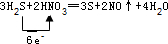 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com