
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的组成计算相关物理量,注意摩尔质量在数值上等于相对分子质量;
解答 解:M(Na2SO4•10H2O)=322g/mol,n(Na2SO4•10H2O)=$\frac{m}{M}$=$\frac{483g}{322g/mol}$=1.5mol,n(Na+)=2n(Na2SO4•10H2O)=2×1.5mol=3mol,m(Na2SO4)=1.5×142=213g,故答案为:1.5NA;213g.
点评 本题考查物质的量的相关计算,题目难度不大,注意相关物理量的计算公式的运用,并注意物质的构成来解答,注意阿伏加德罗常数的含义.


科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性:CH3COOH>H2CO3 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1NaHCO3溶液等体积混合:3[c(CO32-)+c(HCO3-)+c(H2CO3)]=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
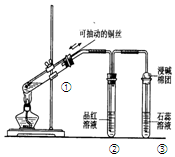
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液褪色 | |
| C. | ③中石蕊溶液变红色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯的物质的量共1 mol,其混合物完全燃烧生成3 mol H2O | |
| D. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂,氧化产物、还原产物都是N2 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀 | |
| B. | 原电池中,一定由活泼性强的金属作负极,发生氧化反应 | |
| C. | 原电池放电时的负极和电解池充电时的阴极均发生氧化反应 | |
| D. | 可充电电池充电时,负极与电源负极相连,正极与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系是纯净物 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A2-)>c(H2A) | B. | c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | ||
| C. | c(Na+)=c( HA-)+c(H2A) | D. | c(H+)=c(A2-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com