
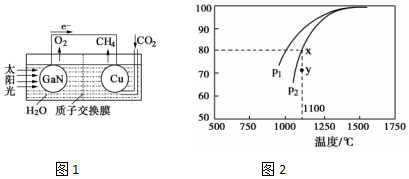
 ��Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���飮
��Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���飮���� ��1�����ɵ��װ��ͼ��֪��Cu�缫�϶�����̼�õ������ɼ��飻
�������������Ʋ����ṩ���ӣ�Ӧѡ�����
��2������ҺΪ��ˮ������ΪNH4HS������Һ����������Ӧ����������һˮ�ϰ�������ԭ���غ�͵����غ���д��ѧ����ʽ��
��3���ٸ��ݻ�ѧƽ�ⳣ�������������д������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ���
�ڸ÷�Ӧ����Ϊ�������ķ���ѹǿԽ��CH4��ת����ԽС��ѹǿΪP2ʱ����Y�㷴Ӧδ�ﵽƽ�⣬��Ӧ�����ƶ���
��� �⣺��1�����ɵ��װ��ͼ��֪��Cu�缫�϶�����̼�õ������ɼ��飬��Cu�缫�ϵĵ缫��ӦΪ��CO2+8e-+8H+=CH4+2H2O���ʴ�Ϊ��CO2+8e-+8H+=CH4+2H2O��
�ڿ���װ���м�����������������ʣ������������Ʋ����ṩ���ӣ�Ӧѡ�����ᣬ����ѡ�����ᣬ�ʴ�Ϊ�����
��2��H2S���ʳ��ð�ˮ���գ�����ΪNH4HS������ҺΪ��ˮ��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ����������Ӧ����������һˮ�ϰ�������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽΪ��2NH4HS+O2$\frac{\underline{\;һ������\;}}{\;}$2NH3•H2O+2S����
�ʴ�Ϊ��2NH4HS+O2$\frac{\underline{\;һ������\;}}{\;}$2NH3•H2O+2S����
��3������֪CO2��g��+CH4��g��?2CO��g��+2H2��g������ƽ�ⳣ������ʽ��K=$\frac{{c}^{2}��CO��•{c}^{2}��{H}_{2}��}{c��C{O}_{2}��•c��C{H}_{4}��}$���ʴ�Ϊ��K=$\frac{{c}^{2}��CO��•{c}^{2}��{H}_{2}��}{c��C{O}_{2}��•c��C{H}_{4}��}$��
�ڸ÷�Ӧ����Ϊ�������ķ���ѹǿԽ��CH4��ת����ԽС����֪��ͬ�¶��£�P1�����µ�ת���ʴ���P2����P1С��P2��ѹǿΪP2ʱ����Y�㷴Ӧδ�ﵽƽ�⣬��Ӧ�����ƶ�������v����������v���棩��
�ʴ�Ϊ����������
���� ���⿼���˵缫��Ӧ����ʽ����д����ѧƽ�ⳣ����ƽ���ƶ�����Ŀ�漰��֪ʶ��϶࣬�����ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ����������Ŀ�Ѷ��еȣ�


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��Ͻ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ�� ����йص���
����йص���
A��ˮ���ȵ��ܸߵ��¶ȶ����Էֽ�
B��ˮ��ɱ�������ͣ��ܶȱ�С
C��CH4��SiH4��GeH4��SnH4�۵�����Է����������������
D��HF��HCl��HBr��HI�����ȶ������μ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ҵ�ϳɰ���ӦΪ��N2��g��+3H2��g�� $?_{���¸�ѹ}^{����}$ 2NH3��g���������о����£�
��ҵ�ϳɰ���ӦΪ��N2��g��+3H2��g�� $?_{���¸�ѹ}^{����}$ 2NH3��g���������о����£�| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n��H2��/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n��NH3��/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��NH3��=0.1mol•L-1•min-1 | B�� | v��N2��=0.7 mol•L-1•min-1 | ||
| C�� | v��NH3��=0.2mol•L-1•min-1 | D�� | v��H2��=0.3mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������˻ᡰ�����������þ��й��������ɫ���������οչ��գ���ˮ�ĺ�г���ļ��齻������Ϊ�����������������ͬ�ƽ���ƽ�뷢չ����������������ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϣ��Իش��������⣺
�������˻ᡰ�����������þ��й��������ɫ���������οչ��գ���ˮ�ĺ�г���ļ��齻������Ϊ�����������������ͬ�ƽ���ƽ�뷢չ����������������ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϣ��Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
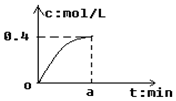 ��Ӧ2SO2+O2?2SO3��a min��SO3Ũ�ȵı仯�����ͼ��ʾ����ʱ��0-a min����O2��ʾ��ƽ����Ӧ����Ϊ0.04mol/��L•min������a���ڣ�������
��Ӧ2SO2+O2?2SO3��a min��SO3Ũ�ȵı仯�����ͼ��ʾ����ʱ��0-a min����O2��ʾ��ƽ����Ӧ����Ϊ0.04mol/��L•min������a���ڣ�������| A�� | 5 | B�� | 2.5 | C�� | 7.5 | D�� | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 Lˮ�������ķ�����ԼΪ6.02��1023�� | |
| B�� | 1 mol Cl2�к��е�ԭ����ΪNA | |
| C�� | ��״���£�a L�����͵����Ļ���ﺬ�еķ�����ԼΪ$\frac{a}{22.4}$��6.02��1023�� | |
| D�� | ���³�ѹ�£�11.2 L CO��������0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʼʱ�۲쵽������Ƭ�����м��������ݣ�����ԭ��Ϊ�ý���Ƭ����������Ĥ | |
| B�� | �����й۲쵽������Ƭ�����д������ݲ���Һ���ϡ���������˵���úϽ���Ƭ���ܶ�С�ڸ�������Һ���ܶ� | |
| C�� | ����������ʵ���Ũ��һ��Ϊ4.0 mol•L-1 | |
| D�� | ��ҺX��Mg2+��Al3+�����ʵ���֮��һ��Ϊ1��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com