
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
分析 C6H14属于烷烃,主链为6个碳原子有:CH3(CH2)4CH3;主链为5个碳原子有:CH3CH2CH2CH(CH3)2;CH3CH2CH(CH3)CH2CH3;主链为4个碳原子有:CH3CH2C(CH3)3;CH3CH(CH3)CH(CH3)CH3,则C6H14的同分异构体共有5种,写出每种结构找对称,确定氢原子的种类,确定己基的种类,据此解题.
解答 解:C6H14属于烷烃,主链为6个碳原子有:CH3(CH2)4CH3;主链为5个碳原子有:CH3CH2CH2CH(CH3)2;CH3CH2CH(CH3)CH2CH3;主链为4个碳原子有:CH3CH2C(CH3)3;CH3CH(CH3)CH(CH3)CH3,则C6H14的同分异构体共有5种,写出每种结构找对称,确定氢原子的种类,确定己基的种类.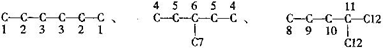 、
、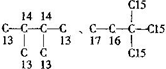 .
.
故选C.
点评 本题考查同分异构体的书写,难度不大,注意掌握烷烃同分异构体的书写方法.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组是 ( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
② | Fe(NO3)2溶液 | AgNO3溶液 | 加入足量铁粉,并过滤 |
③ | O2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
A.①④ B.② C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
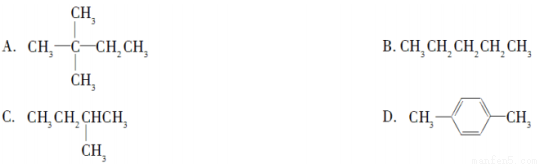
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
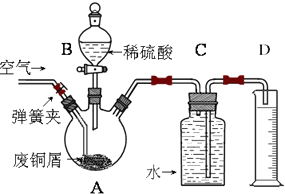 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
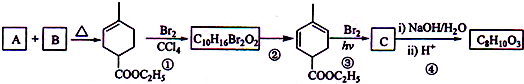
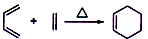
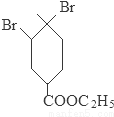 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;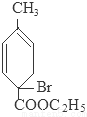 +2H2O
+2H2O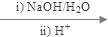
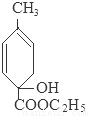 +C2H5OH+HBr:
+C2H5OH+HBr: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
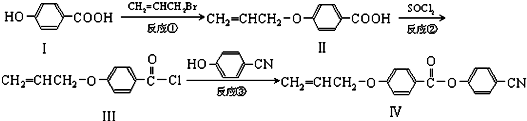
 .
. 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是 .
.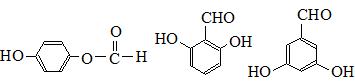 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com