
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | 氢化物的沸点为H2T<H2X | |
| B. | R的氧化物对应的水化物可能具有两性 | |
| C. | X单质在氧气中燃烧生成XO3 | |
| D. | L、X形成的简单离子核外电子数相等 |
分析 L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于R小于L可知应和L同周期,为Al元素,结合元素周期律知识解答该题.
解答 解:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于R小于L可知应和L同周期,为Al元素,则
A.O的电负性较强,形成的氢化物含有氢键,沸点较高,故A错误;
B.根据“对角线规则”,铍的性质与铝相似,具有两性,故B正确;
C.S可在氧气中燃烧只能生成SO2,故C错误;
D.Be2+和Mg 2+的核外电子数分别为2和10,不可能相等,故D错误;
故选B.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
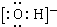 ;
;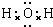 ;
;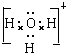 ;
;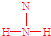 ;
;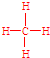 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O 存在于水中 | |
| B. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| C. | 18O 存在于乙酸乙酯中 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数 | |
| B. | 核电荷数和核外电子层排布的电子数 | |
| C. | 中子数和电子数 | |
| D. | 质量数和核外电子层排布的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
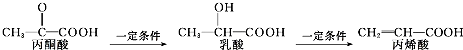
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol乳酸最多能与2molNa发生反应 | |
| D. | 三种有机物均能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液和双氧水的消毒原理相同,且使用时浓度不宜过大 | |
| B. | “低碳经济”主要是指减少对化石燃料的依赖 | |
| C. | 明矾和漂白粉可用于自来水的净化,但两者的作用原理不相同 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可使其消毒能力增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com